- Kui palju on olemas erinevaid aatomeid?
- Mille poolest sarnaneb keemiline element lihtainega?
- Mis juhtub, kui aatomist neutroneid ära võtta või neid sinna lisada?
Viimane looduslik element

1945. aastal avastati lõpuks ka viimane looduslik element. Kuna sel ajal olid päevakorras radioaktiivsed elemendid ja tuumafüüsika, siis tundus see element teadlastele üsna ebahuvitav. Avastus võeti vastu üsna leigelt ning element nimetati promeetiumiks kreeka mütoloogiast tuntud titaani Prometheuse järgi, kes varastas Olümposelt tule ja andis selle inimestele.
Prootonite arv määrab elemendi
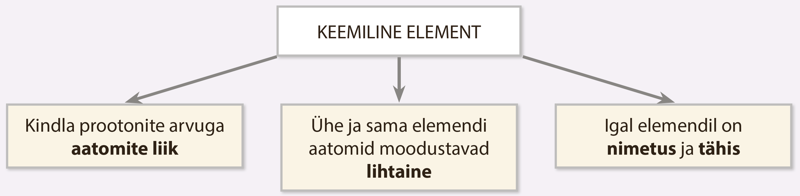
Keemilise elemendi (ehk lihtsalt elemendi) määrab aatomis sisalduvate prootonite arv. Kui aatomituumas on näiteks üks prooton (tabelis roosa pallike), on tegemist vesinikuga, kui tuumas on kaks prootonit, on tegu heeliumiga.
Keemiline element on kindla prootonite arvuga aatomite liik.
Prootonite arv tuumas |
1 |
2 |
8 |
12 |
Tuumaehituse mudel |
 |
 |
 |
 |
Keemiline element |
Vesinik |
Heelium |
Hapnik |
Magneesium |
Tänapäevaks on teada 118 keemilist elementi, millest veidi enam kui 90 leidub looduses. Püsivate aatomitega elemente, mis aja jooksul iseenesest ei lagune, on ligikaudu 80. Peale nende on loodusest leida üle kümne ebastabiilse elemendi ning agarad füüsikud ja keemikud on sünteesinud veel ebapüsivaid elemente. Tutvu tuntumate keemiliste elementidega tabelis õpiku lõpus.
Aatomite liigi ehk keemilise elemendi määrab
- elektronide arv
- neutronite arv.
- prootonite arv.
Keemiline element ja lihtaine
Paljude keemiliste elementide aatomid seostuvad üksteisega, moodustades mitmesuguseid aineid. Kui aine koosneb ühe ja sama keemilise elemendi aatomitest, nimetatakse seda lihtaineks. Tavaliselt on keemilise elemendi ja lihtaine nimetus sama, mistõttu tuleb tähelepanelikult jälgida, millest parasjagu juttu on. Näiteks tähistab sõna „hapnik” nii keemilist elementi (O) kui ka hingamiseks vajalikku lihtainet (O2), mille molekul koosneb kahest hapnikuaatomist.

Lihtaine koosneb
- erinevate elementide aatomitest.
- ainult ühest aatomist.
- ühe ja sama elemendi aatomitest.
Tähised keemias
Igal keemilisel elemendil on ladinakeelne nimetus ja rahvuskeelne nimetus. Samuti on igal elemendil sümbol ehk elemendi tähis. Tähisena on kasutusel elemendi ladinakeelse nimetuse esimene täht sageli koos veel ühe tähega elemendi nimetusest. Näiteks elementi, mille aatomite tuumas on 1 prooton, nimetatakse vesinikuks (ld Hydrogenium) ja elemendi tähis on H. Kaheksa prootoniga aatom on hapnikuaatom, hapnikku (ld Oxygenium) tähistatakse tähega O. Osmiumil (ld Osmium) on 76 prootonit ja selle tähis on Os.

Ühetähelisi tähiseid võib lugeda ühetäheliselt, st elemendist hapnik (O) rääkides võib öelda „oo”. Enamik elemente on tähistatud aga kahe tähega ja kokkuleppeliselt öeldakse tähise asemel elemendi nimetus. Näiteks elemendi heelium tähist He lugedes öeldakse välja „heelium”.
Elemendi nimetus eesti k |
Elemendi nimetus ladina k |
Tähis |
Loe |
Vesinik |
Hydrogenium |
H |
haa |
Hapnik |
Oxygenium |
O |
oo |
Heelium |
Helium |
He |
heelium |
Osmium |
Osmium |
Os |
osmium |
Mõtle
Uuri internetist, mille järgi on oma nime saanud keemilised elemendid fosfor, gallium ja krüptoon. Kuidas nende tähistusi lugeda?
- He
- H
- O
- Heelium
- Vesinik
- Hapnik
Isotoobid
Kuigi neutronitel pole laengut, on neil aatomituumas oluline roll. Nad paiknevad positiivselt laetud prootonite vahel, mis muidu tõukuksid tugevamalt ja aatomituum ei püsiks koos. Erinevalt prootonitest võib kindla keemilise elemendi aatomituumas olla erinev arv neutroneid ning neid ei pruugi olla tuumas prootonitega võrdselt. Näiteks pole universumis kõige levinumal vesinikuaatomil ühtegi neutronit, samas võib leida ka 1 või 2 neutroniga vesinikuaatomeid, Ühe keemilise elemendi erineva neutronite arvuga aatomeid nimetatakse isotoopideks. Mida enam on aatomis neutroneid, seda enam on aatomis tuumaosakesi ja seda suurem on selle aatomi mass.
Isotoobid on sama prootonite arvu, kuid erineva neutronite arvuga aatomid.
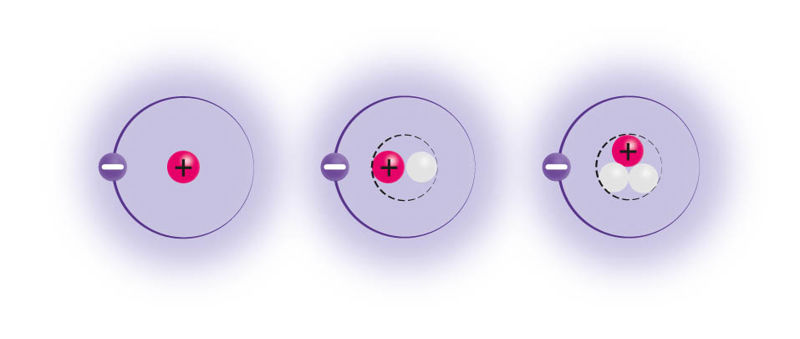
Neutronite arv võib mõjutada aatomite püsivust. Näiteks on uraaniaatomil teada 6 looduslikku isotoopi. Neist tuumakütusena kasutatakse 235 tuumaosakesega (92 prootonit, 143 neutronit) uraaniaatomeid, kuna need on võimelised lagunema üsna kergelt, kutsudes esile ahelreaktsiooni, mille tulemusel vabaneb suures koguses energiat.
Uraan-235 tuumade eripära seisneb selles, et kui tuumad on kord juba lõhustuma hakanud, saab see jätkuda ka ilma väljast saabuvate neutroniteta: protsessis vabanenud neutronid põhjustavad juba järgmiste uraan-235 aatomite lagunemist.
Mõtle
Kuidas saab leida isotoobi neutronite arvu? Mitu neutronit on 238 tuumaosakesega uraani isotoobil?
Lisalugemine
Kangekaelne fluor
Keemiliste elementide avastamise, uurimise ja nimetuste andmise ajalugu on täis põnevaid juhtumeid. Fluori olemasolust elemendina oldi aastakümneid teadlikud, kuid keegi ei suutnud seda 70 aasta jooksul puhta ainena eraldada. Prantsuse keemik ja apteeker Henri Moissan oli aga väga järjekindel ning pärast paljusid katsetusi ja mürgitusi õnnestus tal fluor 1886. aastal esimest korda eraldada. Ta proovis ka tehislikku teemanti valmistada, kuid avastas hoopis ränikarbiidi, mida kasutatakse tänapäeval autopidurites ja elektroonikas. Mitmete saavutuste eest pälvis Moissan aastal 1906 Nobeli keemiapreemia.

Põnevad elemendid
Keevitajad kannavad töötades maski, et kaitsta oma nägu ja silmi kiirguse eest. Maski kaitseklaasi tegemiseks kasutatakse praseodüümi (Pr) ja neodüümi (Nd) segu. Selline klaas ei lase infrapunakiirgusel silmi kahjustada.

Antimon (Sb) ja selle ühendid on mürgised. Enne nende mürgisuse avastamist kasutati antimoni kosmeetikas ja meditsiinis. Näiteks 3000 eKr kasutasid vanad egiptlased antimonimineraali sebatiiti silmade meikimiseks. Keskajal kasutati antimonist kuulikesi kõhukinnisuse ravis. Kusjuures kuulike läbis organismi muutumatult, see pesti puhtaks ja kasutati uuesti. Kuna tegemist oli haruldase metalliga, siis tavaliselt pärandati see edasi.

Ma tean, et
- Keemiline element on kindla prootonite arvuga aatomite liik.
- Lihtaine on aine, mis koosneb ühe ja sama keemilise elemendi aatomitest.
- Isotoobid on sama prootonite arvu, kuid erineva neutronite arvuga aatomid.
Küsimused ja ülesanded
- Uuri internetist, mille järgi on oma nime saanud keemilised elemendid fosfor ja gallium. Kuidas nende tähiseid lugeda?
- Millise aatomi koostisosa arvu muutumisel muutub keemiline element?
- Milline aatomi ehitusosa määrab aatomi isotoobi?