- Kui palju hapnikku leidub õhus?
- Miks vajame puhast hapnikku?
- Kuidas saadakse puhast hapnikku?
Puhas hapnik
Hapnik moodustab 21% kuiva õhu ruumalast. Teaduses, tööstuses, meditsiinis ja spordis on mõnikord vaja kasutada õhu asemel puhast hapnikku. Näiteks kui kasutada õhku terastalade valmistamisel, siis võivad need tulla rabedad ja ebaühtlased ning nendest ehitatud maja võib kokku kukkuda. Puhast hapnikku vajavad teatud tingimustes ka näiteks astronaudid, mägironijad ja sportlased.

Hapniku saamine laboris
Laboris kasutatakse puhta hapniku saamiseks näiteks hapnikku sisaldavaid ühendeid, mis kuumutamisel lagunevad.
Lagunemisreaktsioon on keemiline reaktsioon, mille käigus aine laguneb kaheks või enamaks aineks.
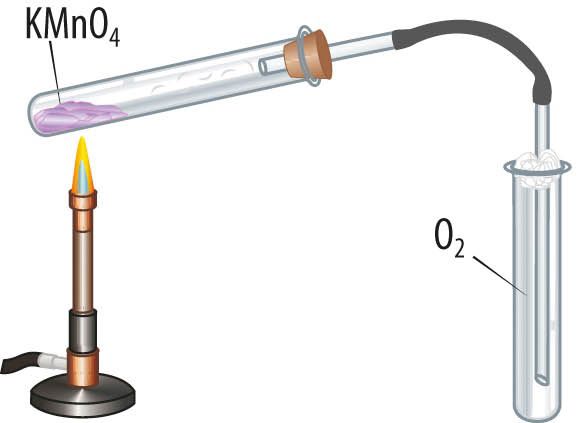
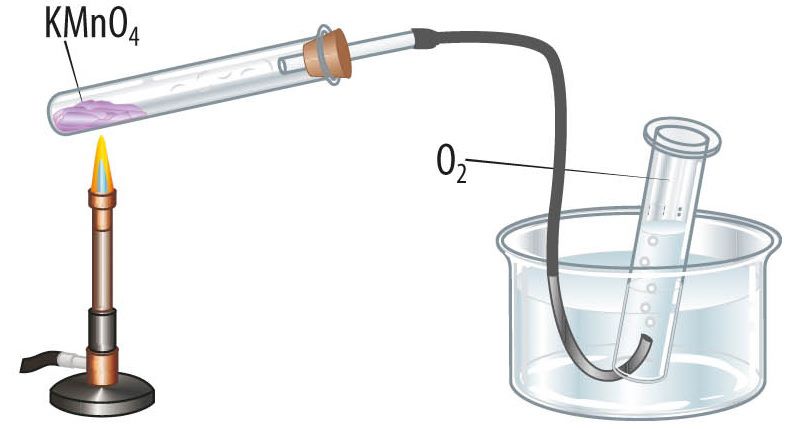
Kaaliumpermanganaat (KMnO4) on lillakas kristalne aine, mis laguneb kuumutamisel katseklaasis, reaktsiooni käigus eraldub gaasiline hapnik.
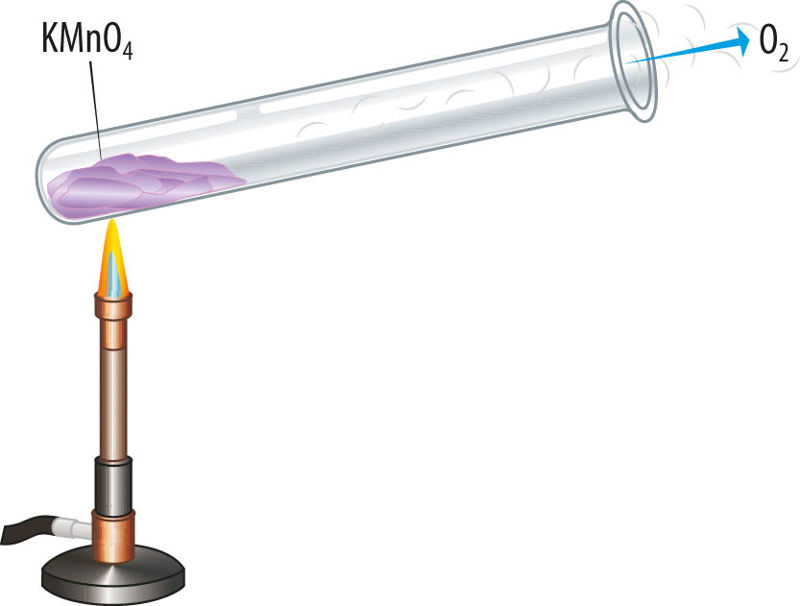
Sama toimub ka näiteks siis, kui kuumutada musta püssirohu ja väetise koostisainet kaaliumnitraati (KNO3).
Aineid, mille lagunemise saaduseks on hapnik, kasutatakse ka lennukite hapnikumaskides, mis lastakse hädaohu korral istmete kohale rippuma. Sellised ained on näiteks naatriumkloraat (NaClO3) ja kaaliumkloraat (KClO3).
Kloraatidega tuleb laboris ettevaatlik olla. Plahvatuse vältimiseks tuleb kasutada puhtaid aineid ning õigeid töövahendeid.

Mõtle
Milline on KClO3 lagunemise reaktsioonivõrrand?
Hapniku kogumine ja tõestamine
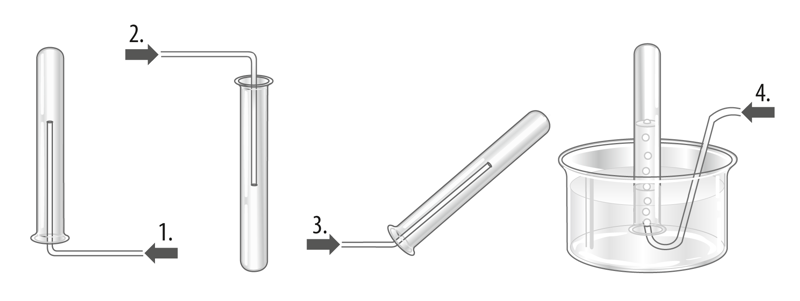
Laboris saab hapnikku koguda kas vati või paberiga kaetud püstisesse katseklaasi või veega täidetud kummulipööratud anumasse. Hapnikku saab tõestada hõõguva pirruga. Hapnikuvaeses keskkonnas hõõguv pird kustub, hapnikurikkas keskkonnas aga hakkab eredalt põlema.
- 1.
- 2.
- 3.
- 4.
Hapniku saamine tööstuses ja kasutusalad
Hapniku saamine tööstuses
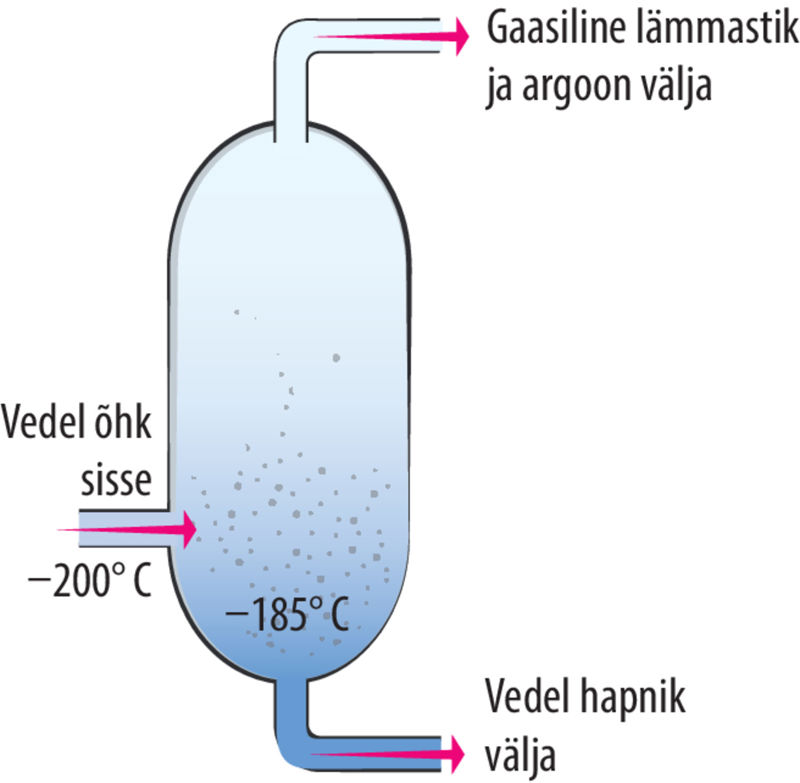
Tööstuses on eesmärk toota aineid alati võimalikult odavalt ja korraga suures koguses. Hapnikku saadakse tööstuses vedela õhu destillatsioonil, st õhk muudetakse vedelaks ning ained eraldatakse segust nende keemistemperatuuride erinevuse põhjal. Esimese sammuna eraldatakse õhust süsihappegaas ja veeaur. Kuivas õhus on 78% lämmastikku, mille keemistemperatuur on −196 °C; 0,9% argooni, mille keemistemperatuur on −186 °C; 21% hapnikku, mille keemistemperatuur on −183 °C. Hapniku eraldamiseks jahutatakse õhk kuni −200 °C, mil see muutub vedelaks. Lämmastiku, argooni ja hapniku eraldamiseks tõstetakse nende segu temperatuuri (kuni −185 °C), argoon ja lämmastik aurustuvad ja eraldatakse gaasidena, järele jääb vedel hapnik.
Tööstuses toodetud hapniku kasutusalad
 |
 |
 |
|
Kasutusala | Terase tootmine | Kosmoselennud | Sport |
Milleks? |
Kaevandatud ja eeltöödeldud rauamaagist mittevajalike lisandite (nt väävli ja fosfori) eemaldamiseks |
Vedela hapniku juuresolek tagab kütuse kiire põlemise, annab raketile tõukejõudu |
Vigastuse põhjustatud paistetuse alandamiseks |
Kuidas? |
Hapnik reageerib väävli ja fosforiga ning reaktsiooni saadused eemaldatakse segust |
Vedel vesinik ja hapnik segunevad ning segu süüdatakse |
Hapniku rõhukambris tõmbuvad veresooned kokku |
- Lämmastik ja argoon eralduvad gaasina.
- Õhk veeldub.
- Segust eraldatakse CO2 ja vesi.
- Vedela segu temperatuur tõstetakse –185 ℃‑ni.
- Saadakse puhas vedel hapnik.
- Õhk jahutatakse –200 ℃-ni.
Ma tean, et
- Hapnikku saab toota nii laboris kui ka tööstuses.
- Laboris saadakse hapnikku näiteks hapnikku sisaldavate ühendite lagunemisreaktsiooni käigus.
- Lagunemisreaktsioon on keemiline reaktsioon, milles aine laguneb kaheks või enamaks aineks.
- Tööstuses saadakse hapnikku vedela õhu destillatsioonil.
Küsimused ja ülesanded
- Mitu lähteainet on lagunemisreaktsioonis?
- Nimeta valdkondi, kus on vaja puhast hapnikku.
- Milline on hapniku keemistemperatuur?