Тип атома определяется числом протонов в его ядре, но для химиков значительно больше интереса представляет то, что происходит вне ядра. Электроны, мельчайшие частицы с массой почти в 2000 раз меньшей, чем у протона, движутся в пространстве вокруг ядра с очень высокой скоростью и образуют электронную оболочку атома. Важность электронов заключается в том, что благодаря им происходят все химические реакции.
Планетарная модель атома схожа по строению с Солнечной системой.
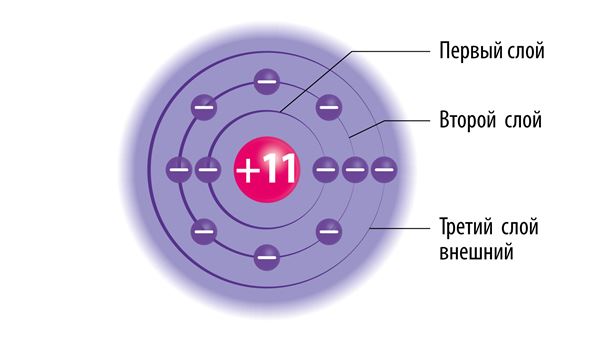
Электронные слои
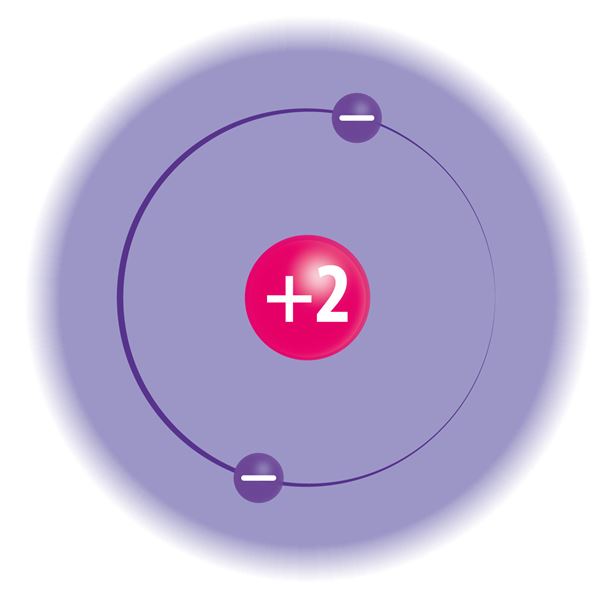
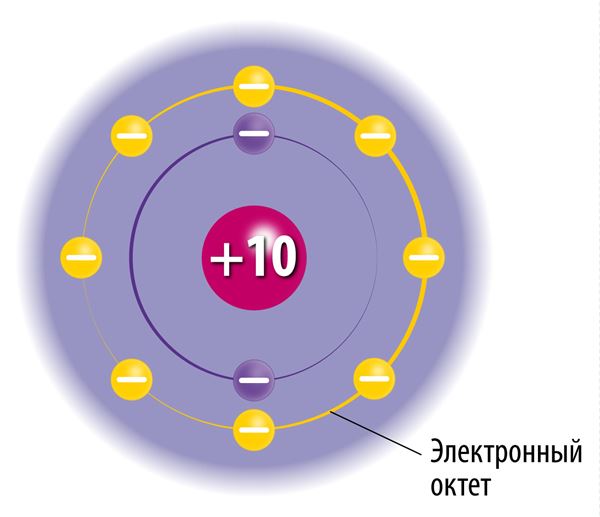
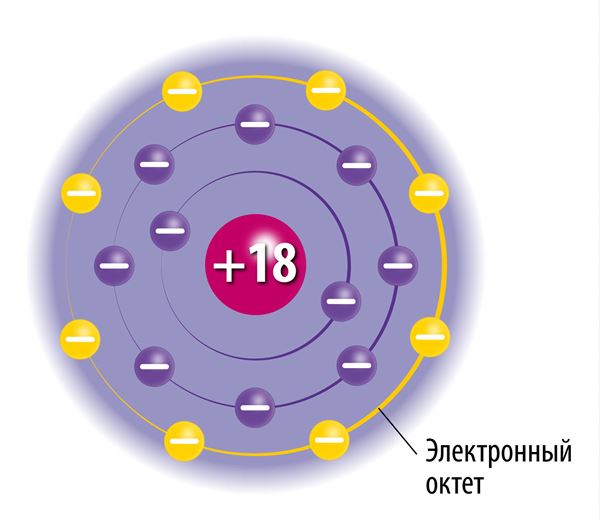
Электронную оболочку образуют быстродвижущиеся электроны. Хотя их движение происходит практически случайно, существуют некоторые закономерности: на определённом расстоянии от ядра может находиться лишь строго определённое число электронов, и ни в коем случае не больше. Электронные слои определяют удалённость электронов от ядра. У атомов может быть до семи электронных слоёв. В первом, самом близком к ядру, электронном слое может находиться максимум 2 электрона. Только у атомов водорода (Н) и гелия (Не) есть лишь один электронный слой. Во втором электронном слое может находиться до 8 электронов. Например, у атомов лития (Li) и кислорода (О) по два электронных слоя. В третьем электронном слое может находиться до 18 электронов.
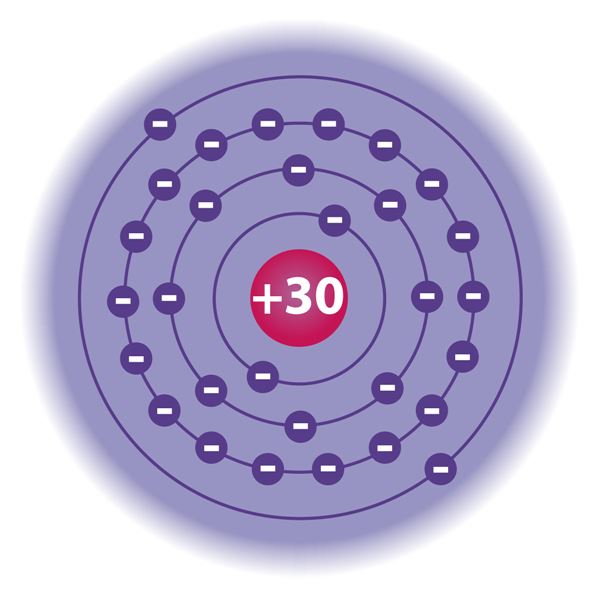
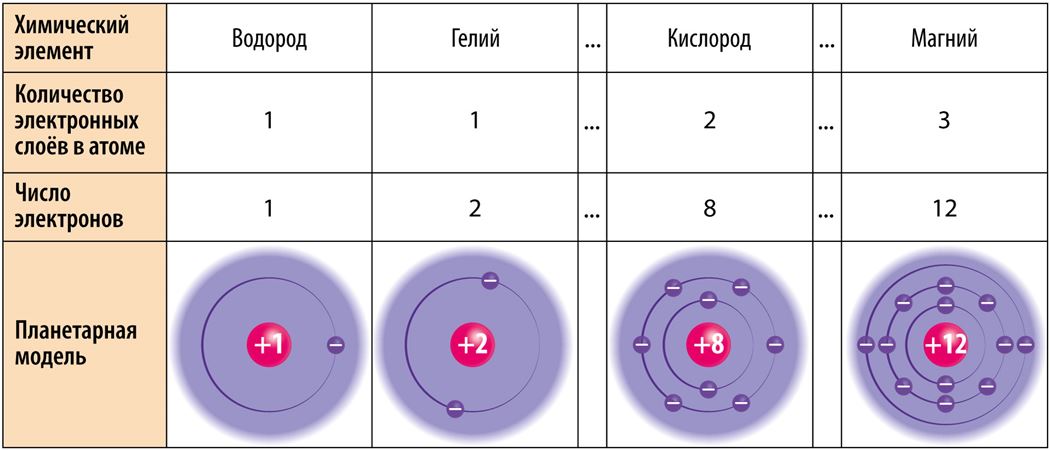
Заполнение электронных слоёв идёт в порядке увеличения их расстояния от ядра: более близкие электронные слои заполняются электронами в первую очередь, то есть сначала заполняется первый электронный слой, затем второй и так далее. Наиболее удалённый от ядра электронный слой называется внешним электронным слоем. В нём может быть до 8 электронов, исключая случаи, в которых внешним слоем является самый первый электронный слой, в котором максимально может находиться лишь 2 электрона.
- Si
- Al
- Na
- N
Строение внешнего электронного слоя
Строение внешнего электронного слоя определяет способность атома участвовать в химической реакции.
Чтобы понять поведение веществ в химических реакциях, необходимо изучить строение атомов этих веществ. В виде единичных атомов могут существовать только так называемые благородные газы (например, гелий, неон и аргон), атомы которых не объединяются между собой и не взаимодействуют с атомами других элементов. Это особое свойство благородных газов объясняется тем, что во внешних электронных слоях их атомов находится по восемь электронов (так называемый электронный октет). Исключением является гелий, в атомах которого во внешнем электронном слое находятся два электрона. Внешний электронный слой в атомах благородных газов полностью заполнен электронами, поэтому атомы этих веществ исключительно стабильны.
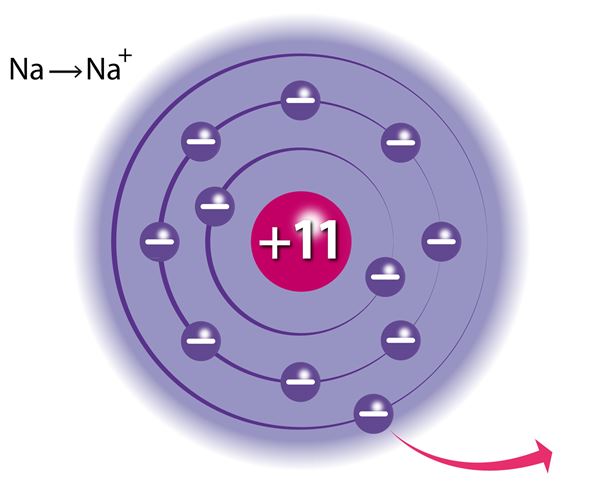
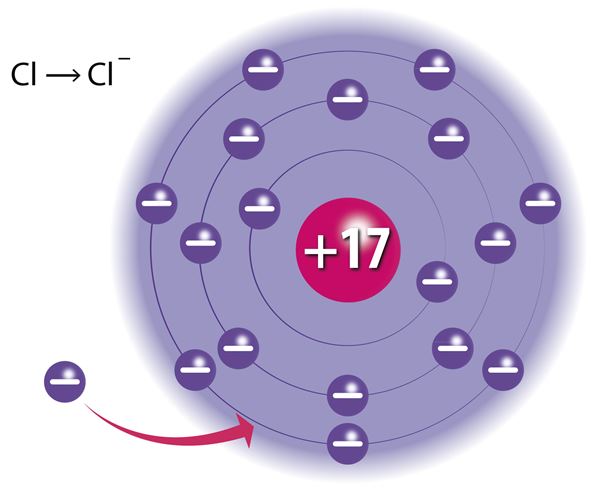
Атомы всех остальных элементов тоже стремятся к достижению такого устойчивого состояния, и это возможно в случаях, если атом принимает во внешний электронный слой дополнительные электроны, отдаёт электроны своего внешнего электронного слоя или разделяет их с другими атомами. Натрий такой же металл, как и железо, но в отличии от последнего он энергично реагирует с водой. Во внешнем (третьем) электронном слое атома натрия находится только один электрон. Такое состояние атома нестабильно, поэтому натрий реагирует с водой, теряя электрон внешнего слоя. Атомы хлора также с лёгкостью вступают в реакции, но в отличие от натрия для достижения электронного октета атом хлора должен принять один электрон на внешний слой (во внешнем электронном слое атомов хлора находится 7 электронов).
Химические реакции происходят благодаря перераспределению или обобществлению электронов внешнего слоя атомов.
В случае электронного октета внешний электронный слой атома полностью заполнен электронами. Этим свойством обладают атомы аргона, ксенона и других Внешний электронный слой гелия также полностью заполнен электронами, но в его слое находится электрона. Вследствие электронного октета эти газы исключительно Атомы других элементов стремятся заполнить свой внешний электронный слой и являются более
Я знаю, что ...
- Электронный слой – часть электронной оболочки атома, в которой движутся электроны.
- Внешний электронный слой (или просто внешний слой) – наиболее удалённый от атомного ядра электронный слой, содержащий электроны.
- Благородные газы – элементы VIIIA (18-ой) группы, в атомах которых внешний электронный слой полностью заполнен.
- Электронный октет – устойчивая электронная конфигурация, в которой атом имеет 8 электронов во внешнем электронном слое.