Ajalooline rooste
Arheoloogilised väljakaevamised annavad olulist infot inimeste elu kohta minevikus. On avastatud vasest, hõbedast ja kullast esemeid. Kuigi rauda on alates rauaajast väga palju kasutatud, on sellest esemeid leitud haruharva. Raud roostetab ja hävib aja jooksul ning seetõttu võib enamasti leida vaid punakaspruuni pudenevat roostet, mis koosneb peamiselt rauaoksiidist. Metallide keemilised omadused võivad olla väga mitmesugused ning neid tuleb silmas pidada metalldetailide valmistamisel.

Metallid on redutseerijad
Metalliaatomite väliskihis on enamasti vähe elektrone, mida aatom keemilistes reaktsioonides üsna kergesti loovutab. Ainet, mille osakesed loovutavad elektrone ehk oksüdeeruvad, nimetatakse redutseerijaks. Elektronide loovutamise tulemusel suureneb metalliaatomi oksüdatsiooniaste (vt ptk 4.6). Aine, mille osakesed liidavad elektrone ehk redutseeruvad, on oksüdeerija ja reaktsiooni käigus selle oksüdatsiooniaste kahaneb. Protsessi, mille käigus elektronid liidetakse, nimetatakse redutseerumiseks. Keemilist reaktsiooni, milles osalevad redutseerija ja oksüdeerija ning elementide oksüdatsiooniastmed muutuvad, nimetatakse redoksreaktsiooniks.
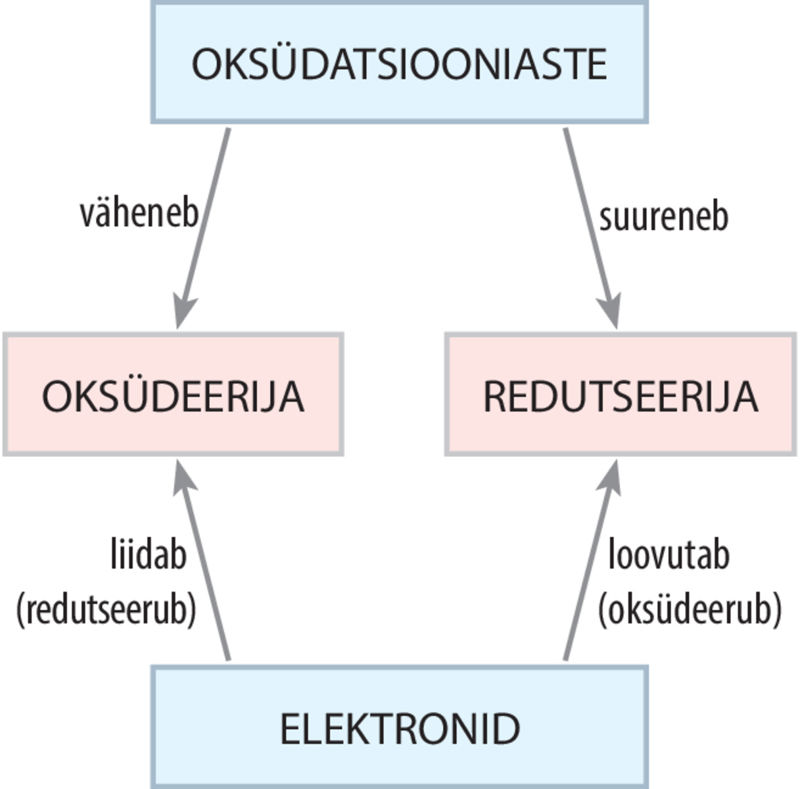
Redutseerija on aine, mille osakesed loovutavad elektrone.
Näiteks magneesium on hõbevalge läikiv ja hästi töödeldav metall, mis õhuga kokkupuutel kattub hapniku toimel tiheda oksiidikihiga. Tegemist on redoksreaktsiooniga, milles magneesium on redutseerija ja hapnik oksüdeerija.
Mõtle
Uuri ja seleta, millest on tuletatud sõnad „redutseerija“ ja „oksüdeerija“.
Selgituseks
Kõik keemilised reaktsioonid pole tingimata redoksreaktsioonid. Mõne reaktsiooni puhul ei muutu ühegi elemendi oksüdatsiooniaste, kuigi tekivad uued ained. Näiteks naatriumhüdroksiidi (NaOH) neutraliseerimisel soolhappega (HCl) tekivad naatriumkloriid (NaCl) ja vesi (H2O).
Metallide pingerida
Nii nagu valime ilmaga sobivaid riideid, peab valima erinevate kasutusalade jaoks sobiva metalli. Seejuures tuleb arvestada peale metallide füüsikaliste omaduste (vt ptk 2.4) ka nende keemiliste omadustega. Näiteks veetorude valmistamiseks kasutatakse vaske, mis ei reageeri veega. Rauast torud roostetaksid hapniku ja vee toimel kiiresti, hakkaksid lekkima ning neid oleks vaja tihti parandada ja vahetada.
Metallide keemiline aktiivsus sõltub sellest, kui kergesti metalliaatomid elektrone loovutavad ja katioone moodustavad. Aktiivsuse alusel järjestatakse metallid pingeritta.
Metallide pingerida

Pingerida algab aktiivsete metallidega (Li, K, Ca, Na) ning lõpeb väheaktiivsete metallidega (Cu, Hg, Ag, Pt, Au). Pingereas on ka vesinik (H2), kuna see loovutab samuti elektrone ja moodustab positiivselt laetud ioone.
Metallide reageerimine hapnikuga
Hapnik on tuntuim oksüdeerija ja reageerib enamiku perioodilisustabeli elementidega, erandiks on näiteks väärisgaasid ja mõned väheaktiivsed metallid. Metallid reageerivad hapnikuga väga erineva aktiivsusega. Metalli ja hapniku reaktsiooni saaduseks on metallioksiid.
Aktiivsed metallid, näiteks leelis- ja leelismuldmetallid, reageerivad hapnikuga väga kergesti. Õhu käes kattub nende pind kiiresti oksiidikihiga, seetõttu tuleb selliseid metalle hoiustada õhukindlas anumas õli- või petrooleumikihi all.
Keskmise aktiivsusega metallid on toatemperatuuril hapniku suhtes võrdlemisi püsivad. Sellesse gruppi kuuluvad paljud tuntud ja laialt kasutatavad metallid (nt alumiinium, kroom). Õhuga kokku puutudes kattub metalli pind õhukese tiheda oksiidikihiga, mis kaitseb metalli edasise oksüdeerumise eest ja muudab selle väga vastupidavaks. Keskmise aktiivsusega metallide pulbrid põlevad, kui need süüdata.
Raud on samuti keskmise aktiivsusega metall, ent selle pind kattub niiskes õhus koheva punakaspruuni roostekihiga. Tekkinud rooste ei kaitse metalli edasise oksüdeerumise eest ja raud hävib aja jooksul. Rooste koosneb peamiselt raud(III)oksiidist.

Väheaktiivsed metallid on hapniku suhtes väga püsivad. Nii ei reageeri väärismetallid (nt kuld, hõbe, plaatina) hapnikuga toatemperatuuril ega kuumutamisel.
Mõtle
Miks on vähetõenäoline, et arheoloog leiab sadade aastate vanuse rauast eseme?
- Au
- Ca
- Ag
- Al
Metallide reageerimine happelahustega
Erineva aktiivsusega metallid reageerivad erinevalt ka hapete lahustega. Metallide pingerida aitab teha järeldusi, kuidas metallid reageerivad hapete lahustega. Kõik pingereas vesinikust vasakul asuvad metallid reageerivad lahjendatud happelahustega. Metalliaatomid loovutavad reaktsiooni käigus elektrone ehk oksüdeeruvad. Happelahuses olevad vesinikioonid (H+) liidavad elektrone ehk redutseeruvad, tekkinud vesinikuaatomid (H) liituvad molekuliks (H2) ja eralduvad gaasina. Metall n-ö tõrjub vesinikku happelahusest välja.
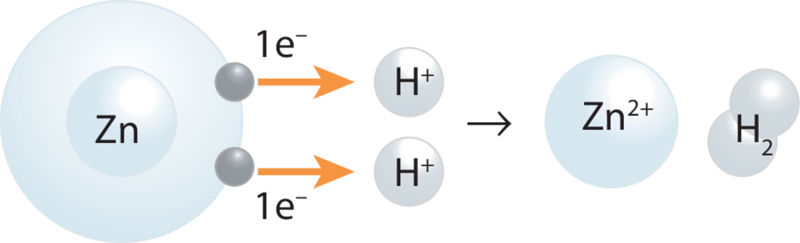
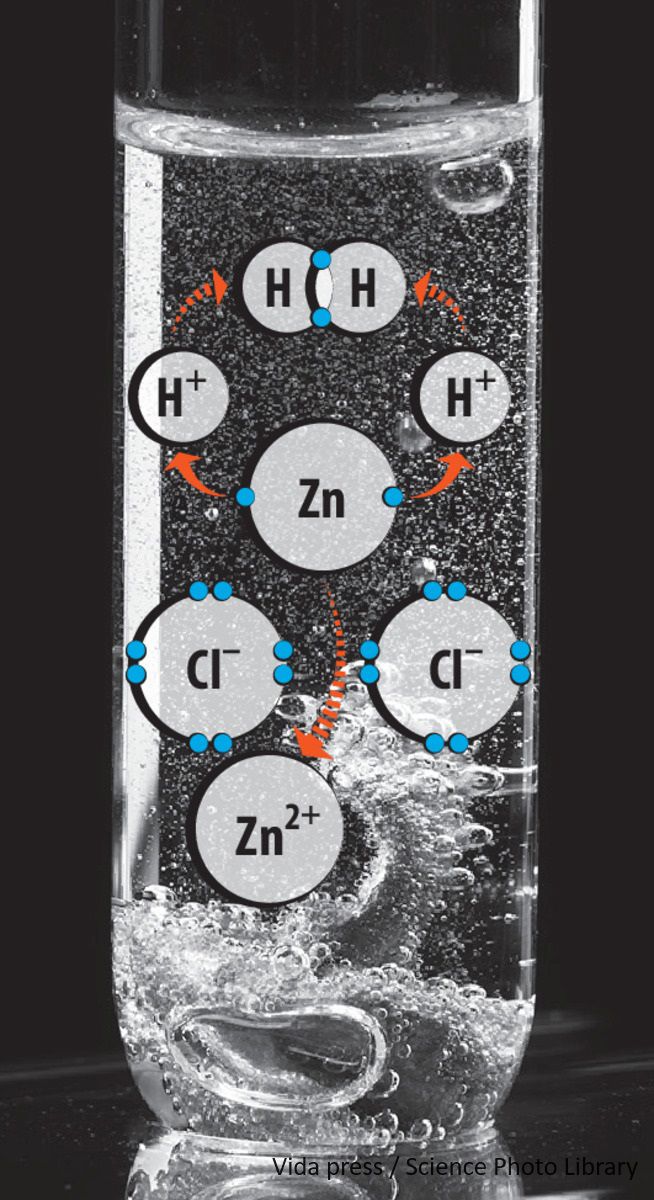
Pingereas vesinikust paremal asuvad metallid lahjendatud happelahusega ei reageeri ja vesinikku välja ei tõrju.
Selgituseks
Metalli ja lahjendatud happelahuse reaktsioonivõrrandi koostamine
Koostame reaktsioonivõrrandi alumiiniumi reageerimise kohta väävelhappega. Esmalt kirjutatakse lähteainete valemid.
Nüüd kirjutatakse saaduste valemid. Metall n-ö tõrjub vesinikku happelahusest välja. Reaktsiooni käigus eraldub vesinikumolekul (H2).
Seejärel korrastatakse soola valem, st leitakse ioonide laengute abil indeksid soola valemisse.
Kõige lõpuks tasakaalustatakse reaktsioonivõrrand. Happeaniooni vaadeldakse ühe tervikuna.
Ma tean, et
- Redutseerija on aine, mille osakesed loovutavad elektrone (oksüdeeruvad).
- Oksüdeerija on aine, mille osakesed liidavad elektrone (redutseeruvad).
- Redoksreaktsioon on keemiline reaktsioon, milles osalevad redutseerija ja oksüdeerija ning aatomite oksüdatsiooniastmed muutuvad.
- Metallid järjestatakse aktiivsuse alusel pingeritta.
- Metallide pingerida algab aktiivsete metallidega ja lõpeb väheaktiivsete metallidega.
- Pingereas vesinikust vasakul asuvad metallid reageerivad lahjendatud happelahustega.
- Pingereas vesinikust paremal asuvad metallid lahjendatud happelahustega ei reageeri.
Jätan meelde!
Aktiivsed metallid Li K Ca Na |
Keskmise aktiivsusega metallid Mg Al Zn Cr Fe Ni Sn Pb |
H2 |
Väheaktiivsed metallid Cu Hg Ag Pt Au |
|
Ei reageeri lahjendatud hapete lahustega ega hapnikuga |
||
Küsimused ja ülesanded
- Miks on vähetõenäoline, et arheoloog leiab sadade aastate vanuse rauast eseme?
- Milline levinud aine reageerib paljude metallidega?
- Uuri ja seleta, millest on tuletatud sõnad „redutseerija“ ja „oksüdeerija“.
- Kuidas on metallid pingeritta paigutatud?
- Kirjelda erineva aktiivsusega metallide reageerimist lahjendatud happelahustega.