- Aatomitest rääkisid juba Vana-Kreeka filosoofid.
- Tõeliselt teaduslikuks muutus aatomi mõiste alles 20. sajandi alguses.
- Kui suured on molekulid?
Aatomiteooria ajaloost
Tänapäeval ei kahtle vist ükski inimene selles, et aine koosneb molekulidest ja aatomitest. Otsene tõestus selle kohta saadi aga alles 20. sajandi lõpupoole. Nüüdisajaks on mikroskoopia meetodid arenenud tasemeni, mis võimaldavad üksikuid aatomeid „näha”, s.t saada neist visuaalseid kujutisi. Kuni aatomite „nägemiseni” oli aine molekulaarne ehitus rangelt võttes vaid hüpotees. Tõsi küll, selle hüpoteesi paikapidavuse kohta leidus hulgaliselt kaudseid kinnitusi. Esmalt suudeti elektronmikroskoopide abil eristada valgumolekule, mis on vee molekulidest sadu tuhandeid kordi suuremad. Aine molekulaarset ehitust kinnitab kaudselt ka tõsiasi, et sellele hüpoteesile tuginevad teooriad ei ole läinud praktikaga iialgi vastuollu.
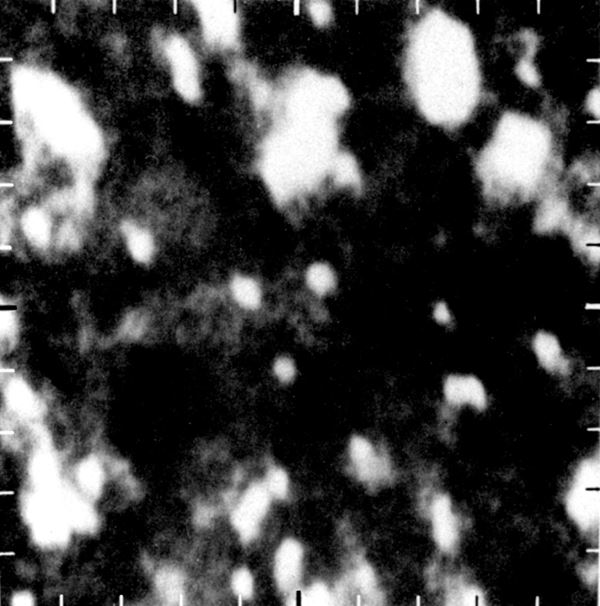
Hüpotees aine atomaarsest ehitusest esines esmakordselt 5. sajandil eKr Vana-Kreeka filosoofide Leukippose ja Demokritose töödes. Sarnaseid ideid propageerisid hiljem ka filosoofid Epikuros (341–270 eKr) ja Lucretius (1. saj. eKr). Sel ajal ei olnud taoliste oletuste tegemiseks muidugi mingit teaduslikku alust. Tol ajal valitses seisukoht, et ainet võib jagada kuitahes väikesteks osadeks. Eespool nimetatud filosoofidele – nn atomistidele tundus see idee absurdsena. Nemad tõidki sisse aatomi (kr ατομος – jagamatu) mõiste.

16.–17. sajandiks oli teadus arenenud niikaugele, et küsimus aine jagatavusest muutus oluliseks ka füüsikutele ja keemikutele. Teaduslik hüpotees aine molekulaarse ehituse kohta võeti kasutusele prantsuse füüsiku Gassendi, inglise teadlase Newtoni ja vene teadlase Lomonossovi töödes. Nendes töödes käsitati ainet mitte kui pidevat keskkonda, vaid kui süsteemi, mis koosneb paljudest jagamatutest osakestest – aatomitest. Tänapäeva molekulaarkineetilise (molekulide liikumist käsitleva) teooria väljatöötamisse andis olulise panuse Ludwig Boltzmann (1844–1906). Molekulaarkineetilisel teoorial oli aga ka hulgaliselt vastaseid. Üks ägedamaid neist, Wilhelm Ostwald, loobus aatomite olemasolu eitamisest alles 1912. aastal. Kuni selle ajani kaitses see keemikuna tuntud teadlane, Nobeli preemia laureaat ja ka Tartu Ülikooli õppejõud nn energetismiteooriat. Selle teooria sisu oli küllaltki arusaamatu, kuid molekulide ja aatomite olemasolu see igal juhul eitas.
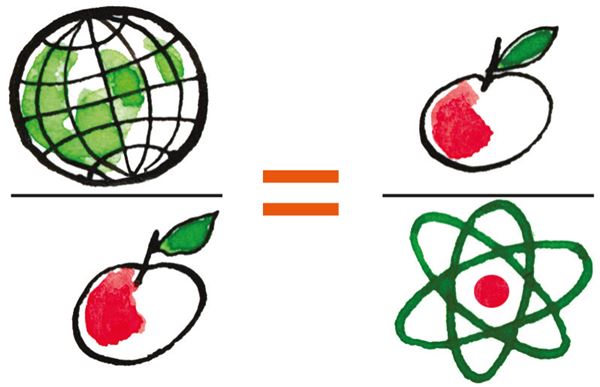
Molekuli mõiste füüsikas
Koolikeemias öeldakse, et molekul on vähim aine hulk, millel on samasugused keemilised omadused kui ainel tervikuna. Füüsikakursuses analoogiliselt väita ei saa. On arusaadav, et üksikul molekulil ei saa olla samasuguseid füüsikalisi omadusi nagu suurel ainekogusel. Mõelgem kas või sellistele omadustele nagu kõvadus, läbipaistvus, elektritakistus jne. Molekulaarfüüsikas nimetatakse molekuliks sellist aineosakest, mis osaleb molekulaarliikumises ehk soojusliikumises. Seega võib füüsikas molekuliks nimetada molekuli keemilises mõttes ja samuti ka üksikut aatomit või iooni. Väljend „üheaatomiline molekul” on füüsikas täiesti lubatav, kuna ka aatomi kohta kasutatakse üldnimetust „molekul”.
Molekuli mass ja läbimõõt
Püüame nüüd arvutuslikult hinnata, kui suur on molekuli mass ja läbimõõt. Võtame näiteks vee molekuli. Keemiast teame, et vee molekulmass on 18 süsinikuühikut. Ühe süsinikuühiku mass on aga 1,660 · 10–27 kg. Korrutades süsinikuühiku massi 18-ga, saamegi vee molekuli massi kilogrammides.
Molekuli suuruse hindamiseks leiame, kui suur on kuup, millesse mahub parasjagu üks vee molekul. Eeldame, et vees on molekulid „pakitud” tihedalt külg külje kõrvale (joon. 1.1.3). Selles veenab meid tõsiasi, et vesi on väga raskesti kokkusurutav. Tegelikult molekulid vedelikus nii korrapäraselt ei paikne, kuid mõõtmete hindamise seisukohalt ei ole see oluline.
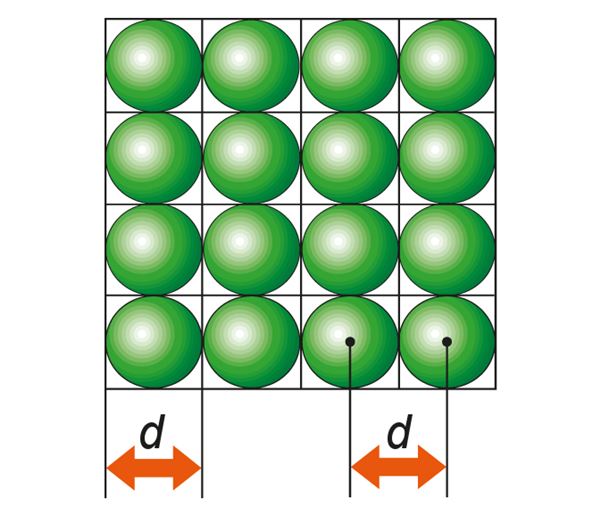
Leiame nüüd ühe kilomooli vee (M = 18 kg) ruumala. Selleks jagame kilomooli vee massi tihedusega . Kui saadud ruumala jagada molekulide arvuga ühes kilomoolis (Avogadro arvuga NA = 6,02 · 1026 molekuli/kmol ehk kmol–1), saamegi kuubi ruumala, millesse mahub parasjagu üks vee molekul. Olles leidnud kuubi ruumala, saame leida ka kuubi serva pikkuse d, võttes kuubi ruumala väärtusest kuupjuure. Tulemus näitab, et molekuli läbimõõt on suurusjärgus 10–10 m. Sellises suurusjärgus on enamiku molekulide mõõtmed. Ülisuured valgumolekulid on muidugi palju suuremad.
Alustame gaasidest
Nüüd aga räägime füüsika sellest osast, mis tegeleb molekulide liikumisega. Füüsika valdkond, mida käsitleme õpiku esimeses peatükis, kannab nimetust gaaside molekulaarkineetiline teooria. See teooria seletab gaaside omadusi, lähtudes järgmistest põhilistest eeldustest:
- gaas koosneb molekulidest,
- molekulid on pidevas kaootilises liikumises,
- molekulide vahel on vastastikmõju.
Miks alustasime just gaasidest? Teaduses püütakse alati uurimist alustada võimalikult lihtsamini uuritavatest objektidest. Molekulaarkineetilise teooria seisukohast võttes on gaas kõikidest agregaatolekutest kõige kergemini uuritav. Antud gaasi kogus võib täita mistahes ruumala, gaas on kergesti kokkusurutav, lihtne on mõõta rõhku, gaasi temperatuuri jne. Seetõttu alustasid ka molekulaarkineetilise teooria rajajad (Boltzmann jt) oma uuringuid just gaasidest.
Küsimused
- Miks oldi veendunud molekulide olemasolus enne, kui molekule suudeti „näha”?
- Mis erinevus on mõistel „molekul” füüsikas ja keemias?
- Tehke läbi arvutus vee molekuli läbimõõdu suurusjärgu hindamiseks.
- Milline on läbimõõdu suurusjärk valgumolekuli puhul, kui selle mass on vee molekuli massist miljon korda suurem?
