- Mille järgi tunneme metalle?
- Millest on tingitud metallide ühised omadused?
- Mis määrab metallide kõvaduse ja sulamistemperatuuri?
Metallide mitmekesisus
Metallid on olnud inimkonna jaoks väga tähtsad materjalid juba üle nelja tuhande aasta (alates pronksiajast).
Metallidel on mitmeid ühiseid omadusi, mille järgi saab neid kergesti ära tunda ja teistest materjalidest eristada. Ometi võivad nad olla kohati lausa vastandlike omadustega: näiteks naatrium on tuhmi kollakashalli kihiga kaetud kerge ja pehme metall, volfram aga väga kõva ja raskesti töödeldav raskmetall. Kuld on kaunis ja kallihinnaline väärismetall, raud on aga üsna odav ja vahel ka roostes, kuid samas tugev ning lisaks ka magnetiliste omadustega metall. On isegi üks metall, mis on tavatingimustes vedel – elavhõbe.
Omaduste suur mitmekesisus võimaldab kasutada metalle väga erinevates valdkondades. Metallide tähtsus on ajas järjest kasvanud, eriti seoses masinaehituse arengu ja elektri kasutuselevõtuga.


Metallide iseloomulikke omadusi
Kuna metallilisi elemente on väga palju, on palju ka vastavaid lihtaineid – metalle. Metallide omadused varieeruvad küll väga laiades piirides, kuid sellegipoolest tunneme metalle kergesti ära nende iseloomulike omaduste järgi.
Tavatingimustes on metallid tahked ained (peale elavhõbeda). Nad on head elektri- ja soojusjuhid ning sile metallipind peegeldab hästi valgust. Enamik metalle on küllaltki plastilised ja kergesti töödeldavad.
Metallide iseloomulikud füüsikalised omadused on tingitud aatomeid ühendavast metallilisest sidemest, mis võimaldab aatomite väliskihielektronidel suhteliselt kergesti liikuda ühe aatomi juurest teise juurde üle kogu metallikristalli.
Metalliline side annab metallidele plastilisuse – see side ei katke ka aatomikihtide nihkumisel üksteise suhtes. Metallilise sideme tõttu on metallid head elektri- ja soojusjuhid – kergesti liikuvad elektronid kannavad hästi edasi nii laengut kui ka soojust.
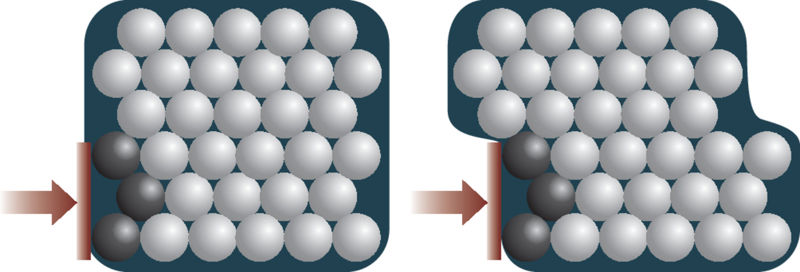
Ühistele iseloomulikele omadustele vaatamata võivad metallid üksteisest siiski tugevasti erineda. Enamik metalle on hallid, kuid mõned on värvilised (kuld ja vask). Magnetilised omadused on vaid mõnel metallil, tuntuimad neist on raud, koobalt ja nikkel. Ka sulamistemperatuurilt, tiheduselt jt füüsikalistelt omadustelt võivad metallid üksteisest tugevasti erineda.
Metallide füüsikaliste omaduste suur varieeruvus on tingitud erinevustest nii elementide aatomiehituses (erinev aatomiraadius, väliskihi elektronide arv jm) kui ka metallide kristallivõre ehituses.

Metallide sulamistemperatuur
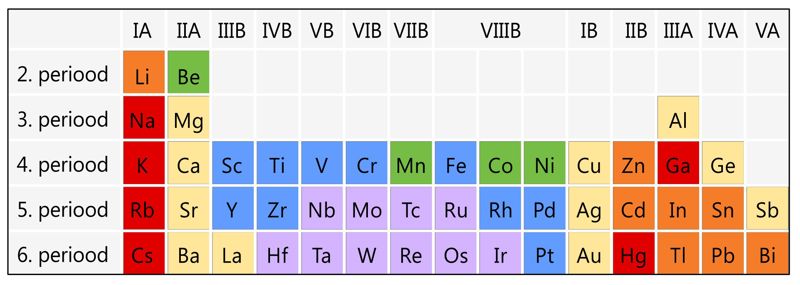
Metallide sulamistemperatuur () oleneb nii vastava elemendi aatomiehitusest kui ka metallilise sideme osatähtsusest keemilises sidemes. Metalliline side on küllaltki nõrk ja seetõttu on valdavalt metallilise sidemega metallide sulamistemperatuur suhteliselt madal. Seepärast ongi leelismetallide sulamistemperatuur reeglina oluliselt madalam kui teistel sama perioodi metallidel. A-rühmade metallide sulamistemperatuur perioodis vasakult paremale reeglina kasvab, sest samas suunas kasvab ka väliskihielektronide arv ja kovalentse sideme osatähtsus. (Erandiks on vaid IIIA rühma metallid alates galliumist, mille sulamistemperatuur on oluliselt madalam kui eelnevatel leelismuldmetallidel. Üks olulisimaid kõrvalekalde põhjusi on see, et nende vahel asuvad siirdemetallid.)

Kõige suurem on kovalentse sideme osatähtsus siirdemetallides, eriti 5. ja 6. perioodi keskosas. Seetõttu ongi kõrgeima sulamistemperatuuriga metallid volfram () ja tema lähinaabrid perioodilisustabelis (, , , jt). Praktikas tähtsaim metall – raud – kuulub samuti küllaltki kõrge sulamistemperatuuriga metallide hulka (). Suur erand on elavhõbe, milles aatomitevaheline keemiline side on väga nõrk ja mille sulamistemperatuur on seetõttu eriti madal ().
Praktikas on otstarbekas jaotada metalle madala, keskmise ja kõrge sulamistemperatuuriga metallideks.

Metallide sulamistemperatuure
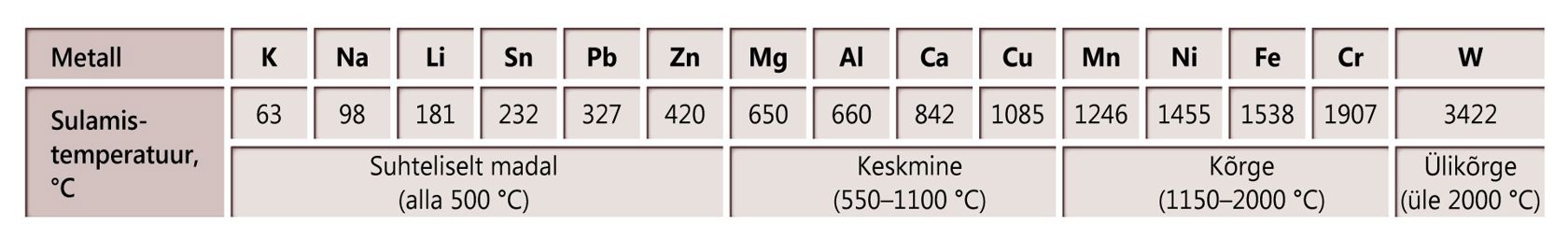
Tähistused: punane – kuni 100 ℃; oranž – 100 kuni 500 ℃; kollane – 500 kuni 1100 ℃; roheline – 1100 kuni 1500 ℃; sinine – 1500 kuni 2000 ℃; lilla – üle 2000 ℃.
a. Temperatuuril :
- Al
- Hg
- Sn
- Fe
- Na
b. Temperatuuril :
- Al
- W
- Sn
- Fe
- Na
c. Temperatuuril :
- Al
- W
- Sn
- Fe
- Cu
Metallide tihedus
Metalli tihedus on üldreeglina seda suurem, mida suurem on vastava elemendi aatommass ja mida väiksem on aatomi raadius. Perioodilisustabeli rühmades ülevalt alla metallide tihedus üldiselt kasvab, sest aatommass selles suunas suureneb (kuigi ka aatomiraadius selles suunas suureneb, on selle mõju tihedusele väiksem kui aatommassi muutusel).
Kõige suurema tihedusega metall on osmium (). Ka teised 6. perioodi rea keskosas olevad metallid on väga suure tihedusega (ka sulamistemperatuur on neil enamasti üsna kõrge). Kõige väiksema tihedusega, s.t „kõige kergem“ metall on liitium ().
Kuna praktikas on metallide tihedus väga oluline, siis on otstarbekas jaotada metalle väikese, keskmise ja suure tihedusega metallideks. Igapäevaelus nimetatakse metalle tavaliselt kergmetallideks () ja raskmetallideks (). Tuntuimad kergmetallid on magneesium, alumiinium ja titaan.

Metallide tihedusi
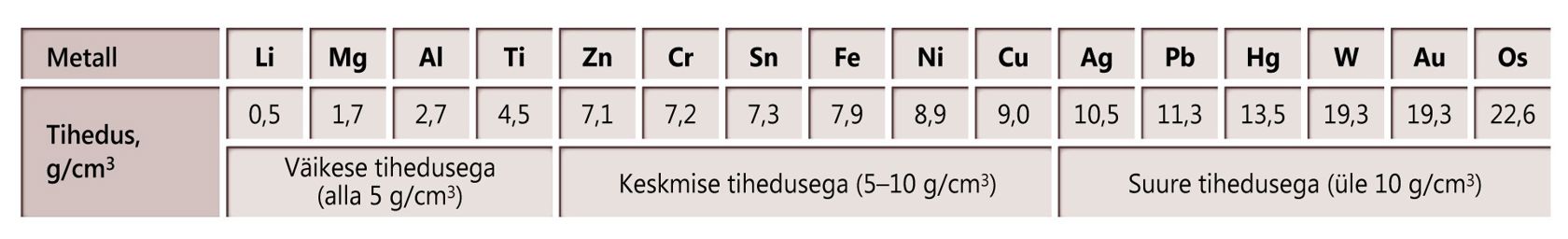
Tähistused: punane – kuni 2,0 g/cm3; oranž – 2,0 kuni 5,0 g/cm3; roheline – 5,0 kuni 10,0 g/cm3; sinine –10,0 kuni 15,0 g/cm3; violetne – üle 15,0 g/cm3.
- Ni
- Ti
- Cu
- Li
- W
- Zn
- Fe
- Al
- Au
- Ag
- Mg
Metallide elektrijuhtivus
Tänu heale elektrijuhtivusele on metallid olnud ligi kaks sajandit asendamatu materjal nii elektrijuhtmete valmistamiseks kui ka kasutamiseks elektri- ja elektroonikaseadmetes. Ilma metallideta ei oleks võimalik käivitada autosid või lennukeid, jälgida tele- või raadiosaateid, kasutada mobiiltelefone jne.
Kõigist metallidest parim elektrijuht on hõbe, paremuselt teine on vask. Paremate elektrijuhtide hulka kuuluvad ka kuld ja alumiinium.
Praktikas kasutatakse elektrijuhtidena kõige enam vaske ja alumiiniumi. Alumiinium juhib elektrit vasest märgatavalt halvemini, pealegi kipuvad alumiiniumi ühendused vähemaktiivsete metallidega (nt vasega) kergesti korrodeeruma, mis halvendab elektrijuhtivust veelgi. Seepärast eelistatakse elektrijuhtmete materjalina enamasti vaske, hoolimata tema märgatavalt kõrgemast hinnast.
Hõbedat ja kulda nende kõrge hinna tõttu tavalistes elektrijuhtmetes ei kasutata. Korrosioonikindluse tõttu on hõbe ja eriti kuld aga asendamatud materjalid kontaktide loomiseks elektroonikaseadmetes. Kuigi ka mitmed s-metallid on küllaltki head elektrijuhid, ei sobi nad elektrijuhtmetena kasutamiseks oma suure keemilise aktiivsuse tõttu.


Metallide kõvadus
Metalli kõvadus iseloomustab tema vastupidavust kriimustamise suhtes. Metallid, milles aatomite vahel on valdavalt metalliline side, on üsna pehmed ja plastilised. Seetõttu on leelismetallid ja mõnevõrra ka leelismuldmetallid küllaltki pehmed. Leelismetalle saab üsna kergesti noaga lõigata. Suhteliselt pehmed on ka mõned p-metallid ja siirdemetallid – tuntuimad neist on plii ja kuld, mida saab isegi küünega kriimustada.
Mida suurem on kovalentsete sidemete osatähtsus, seda kõvem on ka vastav metall. Sellepärast tüüpilised siirdemetallid ongi väga kõvad, eriti need, mis asuvad d-metallide reas suhteliselt keskel.

Lisandid enamasti tõstavad metallide kõvadust. Puhas raud pole nt kaugeltki nii kõva kui malm ja teras. Kuigi kroomi peetakse sageli kõige kõvemaks metalliks – ta kriimustab isegi klaasi –, on temagi suur kõvadus tingitud põhiliselt lisanditest. Väga puhas kroom on suhteliselt plastiline ja hästi töödeldav metall.
Metalli kõvadust saab mõjutada ka vastava töötlusega. Hästi tuntud on raua (terase) „karastamine“ – tugevasti (punase hõõguseni) kuumutatud raudese visatakse järsult külma vette. Kiirel jahtumisel metalli struktuur muutub ja ta kõvadus suureneb.

- Na
- Fe
- Pb
- W
- Cu
- Cr
- Ni
- Au
a. Elektrijuhtmete materjal:
- Na
- Fe
- Cu
- Hg
- Al
b. Kergete sulamite koostismetall (nt lennukiehituses):
- Ca
- Mg
- Ti
- W
- Al
c. Lampide hõõgniitide materjal (rasksulav materjal):
- K
- Fe
- W
- Ga
- Sn
d. Õnnevalamine:
- Na
- Hg
- Fe
- Sn
- Ag
Kokkuvõtteks
- Metallide iseloomulikud omadused on tingitud metallilisest sidemest.
- Metalliline side moodustub aatomitele ühiseks muutunud väliskihielektronide abil, mis saavad suhteliselt kergesti liikuda ühe aatomi juurest teise juurde.
- Perioodis vasakult paremale:
A-rühmade metallide sulamistemperatuur reeglina kasvab,
siirdemetallidel algul kasvab, seejärel kahaneb.
- Rühmas ülevalt alla:
A-rühmade metallide sulamistemperatuur reeglina kahaneb,
siirdemetallidel reeglina kasvab.
Metallide sulamistemperatuuri kasvu üldine suund perioodilisustabelis:
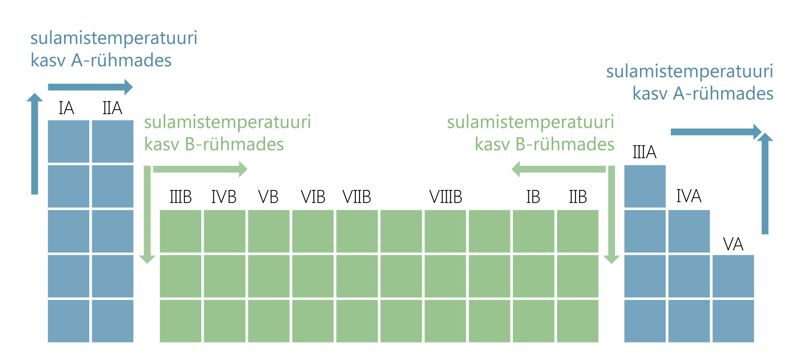
- Kui ülekaalus on metalliline side, on metalli sulamistemperatuur küllaltki madal ja metall suhteliselt
pehme. - Kui ülekaalus on kovalentne side (siirdemetallidel), on metalli sulamistemperatuur kõrge ja metall suure kõvadusega.
- Rühmas ülevalt alla metallide tihedus tavaliselt
kasvab (aatommassi suurenemise tõttu).
Küsimused
- Kuidas on moodustunud metalliline side metallides?
- Kuidas muutub A-rühmade metallide sulamistemperatuur rühmas ülevalt alla?
- Miks on tüüpiliste siirdemetallide sulamistemperatuur eriti kõrge?
- Milline on kõige kõrgema ja milline kõige madalama sulamistemperatuuriga metall?
- Millised on praktikas olulised kergmetallid?
- Milline on kõige väiksema ja milline kõige suurema tihedusega metall?
- Miks juhivad metallid hästi elektrit?
- Millised on parima elektrijuhtivusega metallid?
- Miks on metallid küllaltki plastilised (hästi töödeldavad)?
- Miks on leelismetallid üsna pehmed?
- Miks on kõige kõvemad metallid just siirdemetallid?


