- Mis on aatomiehituse mudelid ja milleks neid vaja on?
- Millised olid esimesed aatomiehituse mudelid (enne Bohri mudelit)?
- Millised on Bohri aatomiehituse mudeli põhiseisukohad?
Aatomiehituse käsitluse ajaloost
Kujutlus ainete jagamatutest koostisosakestest – aatomitest (atomos, kr k – „jagamatu“) – pärineb Vana-Kreekast, eelkõige filosoof Demokritoselt (V–IV saj eKr). Demokritose järgi on aatomid muutumatud ja jagamatud osakesed, mis võivad olla erineva kuju või suurusega. Ka mitmed teised Vana-Kreeka filosoofid, sh Aristoteles, oletasid, et materiaalne maailm pole pidev, vaid koosneb väikestest osakestest. Samas ei toetanud nad mõningaid Demokritose seisukohti, nt aatomite täielikku muutumatust.
19. saj algul esitas inglise teadlane John Dalton katseandmetel põhineva käsitluse aatomitest kui keemiliste elementide väikseimatest jagamatutest osakestest. Iga elemendi aatomitel on iseloomulik suurus ja mass. Väikseimate aatomitega element on vesinik, seepärast valis Dalton vesiniku aatomi tingliku massi aatommassiühikuks.
Dalton avastas ühtlasi, et eri elementide aatomid saavad omavahel ühineda, moodustades nn liitaatomeid (s.t molekule).


Milleks on vaja aatomiehituse tundmist
Keemial on teaduse ja õppeainena üks oluline eelis: tal on ülevaatlik süsteem – keemiliste elementide perioodilisussüsteem –, mis võtab kokku suure osa keemia teoreetilistest alustest. Keemiliste elementide perioodilisussüsteemi sisuline väärtus seisneb selles, et elementide asukoht perioodilisustabelis on otseselt seotud nende aatomiehitusega: elektronkihtide ja väliskihi elektronide arvuga jne. Kui tunneme aatomiehituse põhialuseid, siis oskame lugeda ka perioodilisustabelisse peidetud infot keemiliste elementide ja nende ühendite omaduste kohta.
Aatomiehituse põhialused
Meenutame aatomiehituse kohta varem õpitut. Aatomid on üliväikesed aineosakesed (nt vesiniku aatomi läbimõõt on umbes 10–8 cm ehk 0,1 nm). Aineosakesena on aatom neutraalne, kuid enamik aatomeid saab elektrone loovutada ja mingi osa neist saab ka elektrone siduda, omandades vastava laengu.
Aatomi keskel asub ülisuure tihedusega ja aatomist umbes 100 000 korda väiksem aatomituum. Tuuma mass moodustab põhiosa (vähemalt 99,95%) kogu aatomi massist. Aatomituuma ümbritsev elektronkate on seega väga hõre.


Aatommass – aatomi mass aatommassiühikutes (amü).
Massiarv on tuumaosakeste arv aatomis.
Massiarv on võrdne aatomi massiga amü-des, mis on ümardatud täisarvuni.
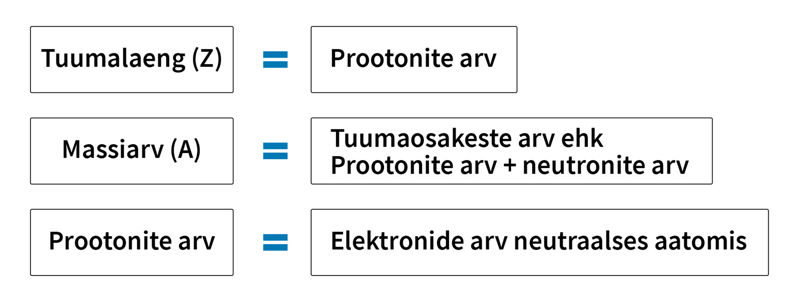
Keemiline element – kindla tuumalaenguga aatomite liik.
Aatomi tuumalaeng Z ehk aatomnumber võrdub elemendi järjenumbriga perioodilisustabelis.
Mis on isotoobid
Isotoobid on sama keemilise elemendi teisendid, millel on erinev neutronite arv (ja seega ka erinev massiarv).
Nimetus isotoop (kr k, „sama koht“) viitab sellele, et sama elemendi isotoobid asuvad perioodilisustabelis samas lahtris. Isotoobi tähistamisel märgitakse elemendi sümboli (E) ette väikeste numbritega tema tuumalaeng Z (allapoole) ja massiarv A (ülespoole): .
Vesiniku isotoobid
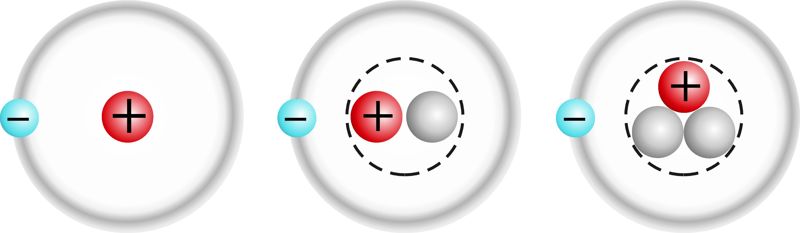
tavaline vesinik (prootium): | raske vesinik (deuteerium): | üliraske vesinik (triitium): |
Enamik keemilisi elemente esineb looduses mitme isotoobi seguna. Näiteks looduslik kloor koosneb kahest isotoobist: ja . Umbes 75% protsenti moodustab sellest isotoop ja 25% isotoop . Loodusliku kloori keskmine aatommass on seetõttu murdarvuline (võrdub ∼35,5).
a. Aatomi tuumalaeng Z võrdub
- massiarvuga,
- tuumaosakeste arvuga,
- prootonite arvuga,
- neutronite arvuga.
b. Aatomi massiarv A võrdub
- elektronide arvuga,
- tuumaosakeste arvuga,
- prootonite arvuga,
- neutronite arvuga.
c. Elektronide arv neutraalses aatomis võrdub
- massiarvuga,
- tuumaosakeste arvuga,
- prootonite arvuga,
- neutronite arvuga.
Aatomiehituse mudelid
Sageli mõistetakse mudeli all mingi keeruka objekti mõnevõrra lihtsustatud ja enamasti ka vähendatud koopiat. Näiteks on gloobus maakera mudel, mänguauto päris auto mudel jne.
Tegelikult on mudel palju laiem mõiste. Mudel peab kajastama vastava objekti mingeid omadusi või seoseid, kuid ei pea sellega kujult tingimata sarnanema. Alati ei tarvitsegi mudel esineda füüsilise keha kujul. Ta võib olla esitatud ka joonisena, skeemina, matemaatiliselt väljendatud teoreetilise arusaamana jne. Seetõttu saab üht ja sama objekti kirjeldada väga mitmesuguste mudelite abil.
Tänapäeva ülivõimsad teravikmikroskoobid võimaldavad saada küll aatomite kujutisi, kuid aatomite sisemist ehitust nad ei peegelda. Aatomiehitusest annavad ettekujutuse vaid kaudsete uuringute põhjal tehtud järeldused ja nende alusel loodud aatomiehituse mudelid.
Varasemates füüsika- ja keemiakursustes tutvusime aatomiehituse Bohri mudeliga. Selle mudeli töötas välja taani füüsik Niels Bohr 1913. a, toetudes inglise teadlase sir Ernest Rutherfordi 1911. a esitatud nn planetaarsele aatomimudelile. Bohri mudel on küllaltki lihtne ja ülevaatlik, kuid keerukamate probleemide lahendamisel tuleb siiski lähtuda tänapäevasest ehk kvantmehaanilisest aatomimudelist. Elektronide liikumine aatomis on tegelikult palju keerulisem, kui on arvestatud Bohri mudelis.

Bohri mudeli põhiseisukohad
Positiivse laenguga aatomituum hoiab koos negatiivse laenguga elektrone, mis moodustavad elektronkatte tuuma ümber. Elektronid tiirlevad ümber aatomituuma ringikujulistel, kindla raadiusega orbiitidel. Iga järgmise elektronkihi elektronide seos tuumaga on nõrgem, nad on kõrgema energiaga ja tiirlevad suurema raadiusega orbiidil.
Elektronkihid täituvad elektronidega energia kasvu järjekorras: kõigepealt tuumale kõige lähem, kõige madalama energiaga elektronkiht, siis järgmine jne. Igasse elektronkihti mahub kindel arv elektrone.
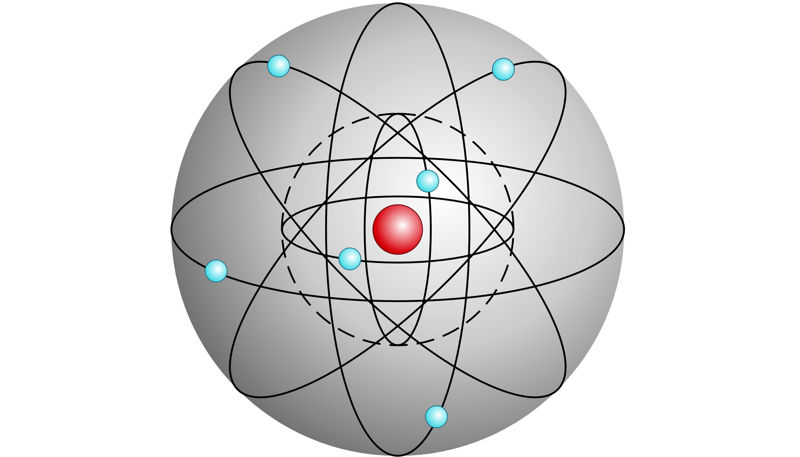
Elektronkihid:
1. kiht – kuni 2 elektroni,
2. kiht – kuni 8 elektroni,
3. kiht – kuni 18 elektroni,
4. kiht – kuni 32 elektroni jne.
Väliskiht on tuumast kõige kaugem elektronkiht, milles asub elektrone. Olenemata sellest, mitmes elektronkiht on antud aatomi korral väliskihiks, saab väliskiht mahutada vaid kuni 8 elektroni (välja arvatud 1. kiht, kuhu mahub ainult 2 elektroni).
Elektronskeem – väljendab elektronide paigutust elektronkihtides.
Elektronskeemis märgitakse elemendi tähise järel tema tuumalaeng ja seejärel elektronide arv elektronkihtide kaupa.
Näited
- Kloori elektronskeem
Cl: +17| 2) 8) 7)
- Kaaliumi elektronskeem
K: +19| 2) 8) 8) 1)
Suuremate aatomite korral tuleb enne märkida väliskihi elektronide arv ja alles seejärel saab leida eelviimase kihi elektronide arvu (nt kaaliumi korral). Arvesta, et väliskihielektronide arv A-rühma elementidel võrdub rühma numbriga.
- Elemendi aatomis on 7 elektroni. Mitu elektroni on selle aatomi väliskihis?
Aatomi väliskihis on elektroni. - Elemendi aatomis on 14 elektroni. Mitu elektronkihti ja mitu väliskihi elektroni on selles aatomis?
Elektronkihte on ja väliskihis on elektroni. - Elemendi aatomi kolmandas elektronkihis on 6 elektroni. Mitu elektroni on selles aatomis?
Aatomis on elektroni.
Ne: +10 |)))) |
Si: + |)))) |
Ca: + | ) ) )) |
P: + | )))) |
Na: + | ) ) )) |
Br: + |)))) |
Lisalugemist. Aatomiehituse mudelite ajaloost
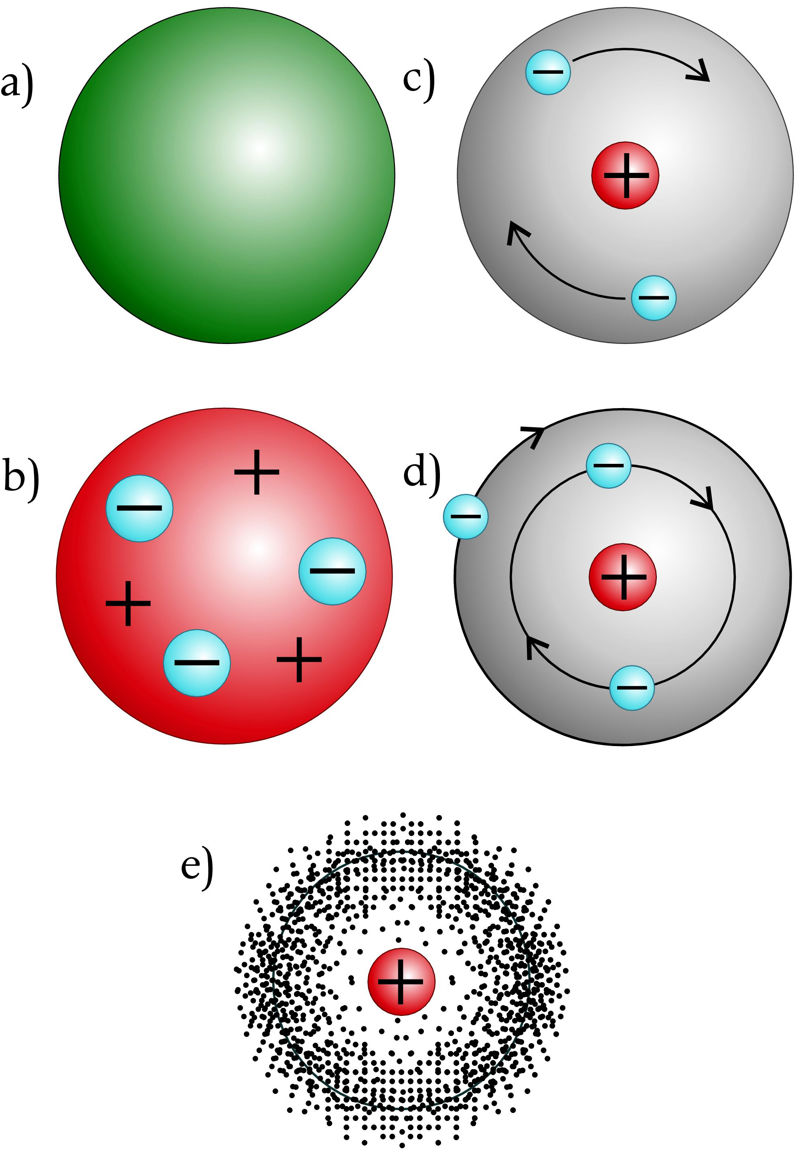
Inglise füüsik J. J. Thomson avastas 1897. aastal, et aatomitest saavad teatud tingimustes eralduda üliväikesed negatiivse laenguga osakesed – elektronid. Sellest tegi ta järelduse, et aatomid polegi jagamatud. Ta oletas, et aatom koosneb positiivse laenguga ainemassist, mis sisaldab vastava arvu negatiivse laenguga elektrone (nagu jõulupuding sisaldab ploome), nii et aatom tervikuna on neutraalne.
Inglise füüsik E. Rutherford tegi 1911. aastal katseliselt kindlaks, et aatom on seest põhiliselt „tühi“, sest aatomi põhimass on koondunud üliväiksesse positiivse laenguga tuuma. Selle põhjal esitas ta aatomiehituse nn planetaarse mudeli: aatomis tiirlevad elektronid ümber tuuma, nagu planeedid ümber Päikese.
Kuna planetaarne mudel oli vastuolus mõningate katseandmetega, vajas see täiustamist. Taani füüsik Niels Bohr koostas 1913. aastal arvutustulemustele tugineva mudeli, mis eeldas, et elektronid saavad aatomis tiirelda vaid tuumast kindlal kaugusel asuvatel ringikujulistel orbiitidel. Bohri mudeli usaldusväärsust kinnitas vesiniku aatomi kohta saadud arvutustulemuste väga hea kooskõla katsetulemustega.
Tänapäevase ehk kvantmehaanilise aatomimudeli järgi polegi võimalik leida elektroni kindlat liikumisteed aatomis. Elektroni liikumist aatomis saab iseloomustada vaid tema leidumise tõenäosusega vaadeldavas ruumiosas.
Küsimused
- Miks on keemia õppimisel vaja tunda aatomiehitust?
- Millest koosneb aatom?
- Milline on seos elemendi tuumalaengu, prootonite arvu ja elektronide arvu vahel (neutraalses aatomis)?
- Mis on massiarv? Mille poolest see erineb aatommassist?
- Mis on keemiline element?
- Mis on isotoobid? Kuidas neid tähistatakse?
- Miks kasutatakse aatomite omaduste käsitlemisel aatomiehituse mudeleid?
- Kuidas liiguvad elektronid aatomis Bohri mudeli järgi?
- Millises järjekorras täituvad aatomi elektronkihid elektronidega? Miks?
- Mitu elektroni asub esimeses kolmes elektronkihis (kihtide kaupa)?
- Mitu elektroni saab maksimaalselt olla aatomi väliskihis (kui see pole esimene elektronkiht)?
