- Kuidas mõjutavad veemolekuli omadused vee omadusi?
- Miks võib vee jäätumine põhjustada mitmesuguseid probleeme?
Vee erilisus
Vesi on üks väheseid aineid, mille tihedus on tahkes olekus väiksem kui vedelas. Vee omadus tahkumisel paisuda võib põhjustada mitmesuguseid probleeme. Näiteks talvel miinuskraadidega, kui vesi jäätub, võivad mureneda kivimid, praguneda vundamendid ja lõhkeda veetorud. Samas võib päästa vee selline omadus talvel veeloomade elu. Jää tihedus on väiksem kui vedelal veel, mistõttu moodustub jää veekogu pinnale ja takistab veekogu läbikülmumist. Nii saavad veeloomad külmaperioodi veekogu põhjas üle elada.

Veemolekul
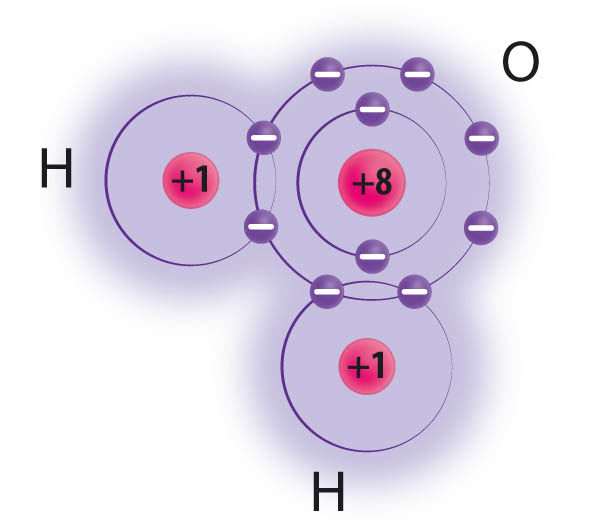
Vesi ehk divesinikoksiid on mittemetallioksiid, mille aineosakeseks on molekul. Ühes veemolekulis on hapnikuaatom seotud kahe vesinikuaatomiga ja vee molekulivalem on H2O.
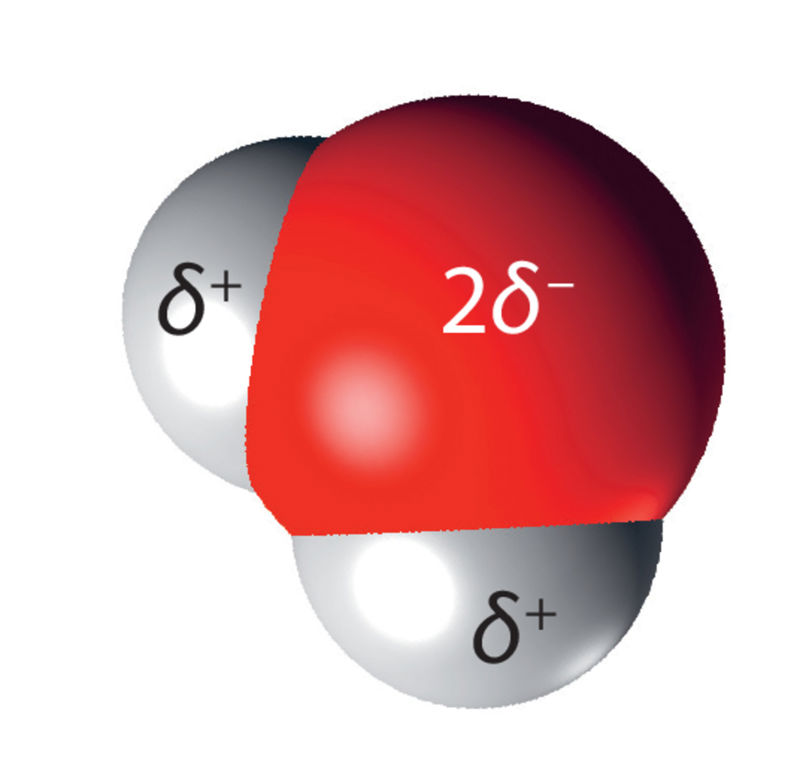
Hapniku- ja vesinikuaatomite vaheline side O–H on kovalentne ja aatomid jagavad elektronipaari, need elektronid liiguvad ümber mõlema aatomituuma. Ühine elektronipaar ei ole hapniku- ja vesinikuaatomi vahel võrdselt jaotunud, hapnikuaatom tõmbab seda enda poole mõnevõrra tugevamini. Seetõttu viibivad ühised elektronid sagedamini hapnikuaatomi kui vesinikuaatomite tuumade läheduses. Kuna elektronid on negatiivse laenguga osakesed, tekivad veemolekulis erineva osalaenguga piirkonnad. Hapnikuaatomil on negatiivne osalaeng (2δ−), kummalgi vesinikuaatomil on positiivne osalaeng (δ+). Molekuli, millel on erineva osalaenguga piirkonnad, nimetatakse polaarseks molekuliks.
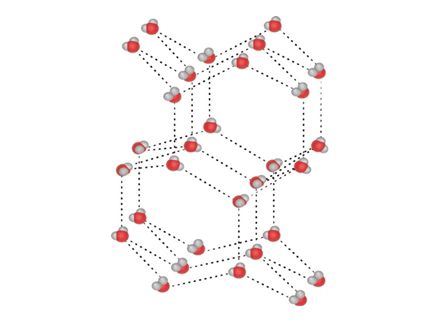
Vesinikside
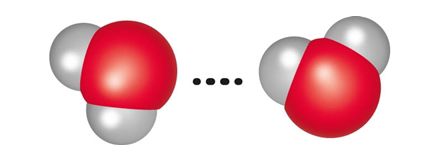
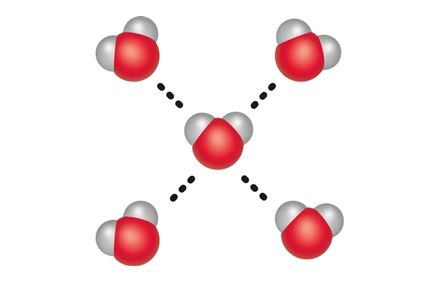
Polaarsuse tõttu esineb veemolekulide vahel vastastiktoime, mida nimetatakse vesiniksidemeks (tähistatakse punktiirjoonega sidet moodustavate aatomite vahel). See moodustub ühe veemolekuli hapnikuaatomi ja teise veemolekuli vesinikuaatomi vahel. Korraga saab üks veemolekul moodustada kuni neli vesiniksidet nelja naabermolekuliga. Suur osa vee omadustest ongi tingitud molekulidevahelistest vesiniksidemetest. Näiteks kui vesi jäätub, st tahkub, suureneb vee ruumala just molekulide vahele moodustuvate kindla suunaga vesiniksidemete tõttu.
- Hapniku- ja vesinikuaatomite vahel olev ühine elektronipaar on nihutatud vesiniku poole.
- Veemolekulis on hapnikul negatiivne osalaeng.
- Veemolekul on polaarne ehk molekulis on erineva osalaenguga piirkonnad.
- Erineva osalaenguga piirkondade tõttu esinevad veemolekulide vahel ioonilised sidemed.
- Üks veemolekul saab moodustada kuni neli vesiniksidet nelja naabermolekuliga.
Ma tean, et
- Vee aineosake on veemolekul.
- Veemolekul on polaarne, sest selles on erineva osalaenguga piirkonnad.
- Polaarsuse tõttu esineb veemolekulide vahel vesinikside, mis moodustub ühe veemolekuli hapnikuaatomi ja teise veemolekuli vesinikuaatomi vahel.
Küsimused ja ülesanded
- Millistest aineosakestest vesi koosneb?
- Kirjelda vee aineosakest (koostis, keemiline side, ehitus).
- Too näiteid igapäevaelust, mis juhtub, kui vesi jäätudes paisub.