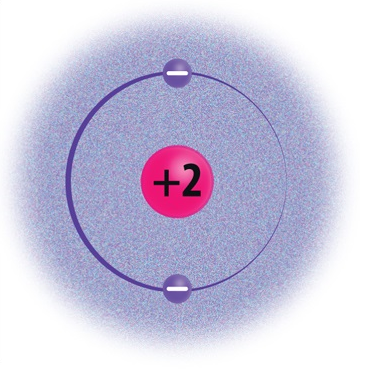
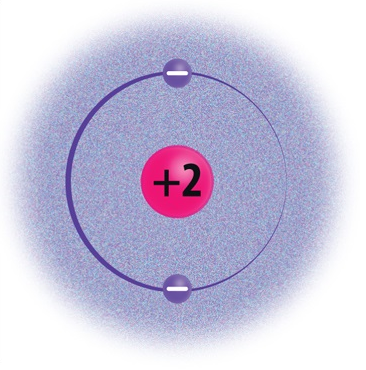
- Miks uuritakse aatomite puhul üldjuhul just elektronkatet?
- Millise väliskihi elektronide arvu puhul on aatom kõige stabiilsem?
Erilised elektronid
Elektronid on ülipisikesed, prootonist ligi 2000 korda väiksema massiga osakesed. Need liiguvad suurel kiirusel ümber aatomituuma ja moodustavad elektronkatte. Elektronid on olulised, sest nende vahendusel toimuvad kõik keemilised reaktsioonid.

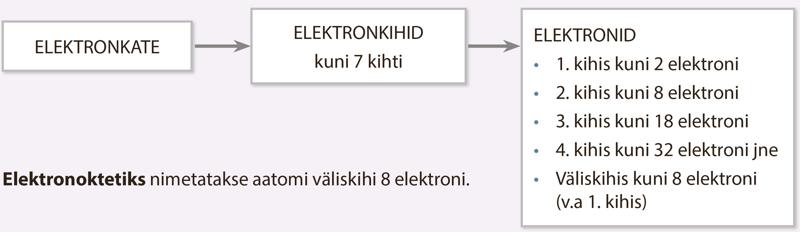
Elektronkihid
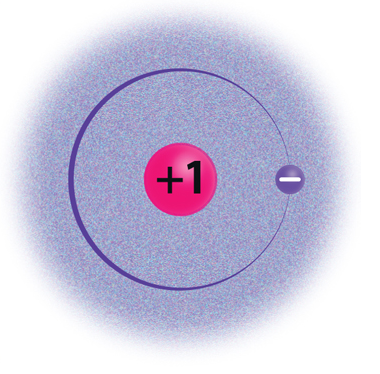
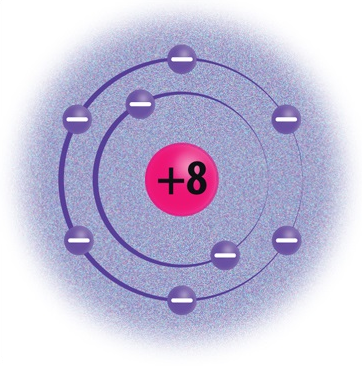
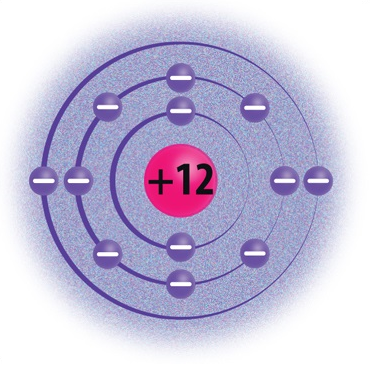
Elektronkatte moodustavad aatomituuma ümber kiiresti liikuvad elektronid. Elektronid liiguvad tuuma ümber elektronkihtides. Aatomil võib olla kuni 7 elektronkihti. 1., s.o tuumale lähimas kihis saab olla maksimaalselt 2 elektroni. Näiteks vesinikuaatomitel (H) ja heeliumiaatomitel (He) on ainult üks elektronkiht. 2. elektronkihis saab olla kuni 8 elektroni. Näiteks liitiumil (Li) ja hapnikul (O) on kaks elektronkihti. 3. elektronkihis saab olla maksimaalselt 18 elektroni, 4. kihis kuni 32 elektroni jne.
Elektronkiht | Maksimaalne elektronide arv |
1. | 2 |
2. | 8 |
3. | 18 |
4. | 32 |
Väliskiht (v.a 1. kiht) | 8 |
Element |
Vesinik |
Heelium |
Hapnik |
Magneesium |
Elektronide arv aatomis |
1 |
2 |
8 |
12 |
Elektronkihtide arv |
1 |
1 |
2 |
3 |
Planetaarne mudel |
 |
 |
 |
 |
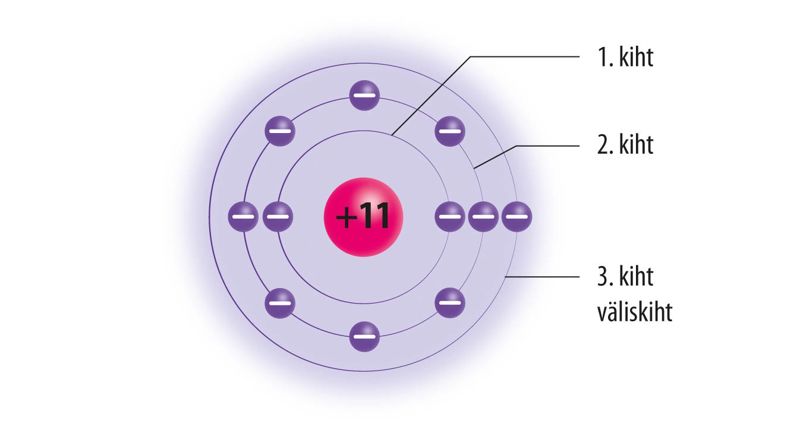
Aatomis on elektronkihid täitunud seestpoolt väljapoole, st kõigepealt 1. kiht, seejärel 2. kiht jne.
Tuumast kõige kaugemal asuvat elektronkihti nimetatakse väliseks elektronkihiks ehk väliskihiks. Väliskihis saab olla kuni 8 elektroni, erandiks on olukord, kus väliskihiks on 1. elektronkiht (sinna mahub maksimaalselt 2 elektroni). Näiteks kui 3. elektronkiht on väliskiht, mahub sellesse kuni 8 elektroni.

Väliskihi ehitus määrab aatomi võime osaleda keemilises reaktsioonis
Selleks et mõista aine keemilisi omadusi, peab uurima selle koostises olevate aatomite ehitust. Üksikute aatomitena esinevad vaid väärisgaasid (nt heelium, neoon ja argoon), nende aatomid ei ühine omavahel ega reageeri teiste elementide aatomitega. Väärisgaasid on äärmiselt püsivad, kuna nende väliskiht on elektronidega täielikult täitunud. Väärisgaaside väliskihis on 8 elektroni (v.a heelium, mille väliskihis on 2 elektroni), mida nimetatakse elektronoktetiks.
Kõikide ülejäänud elementide aatomid püüavad keemilistes reaktsioonides osaledes saavutada väärisgaasidele omast püsivat olekut. Täielikult täitunud väliskiht saavutatakse, kui aatomid liidavad, loovutavad või jagavad oma väliskihi elektrone.
Naatrium on aktiivne metall. Naatriumiaatomi välises, s.o 3. elektronkihis on üks elektron. Selline olek on väga ebapüsiv, mistõttu osaleb naatrium aktiivselt keemilistes reaktsioonides, loovutades oma üksiku väliskihi elektroni. Ka klooriaatom astub kergelt reaktsiooni, kuid erinevalt naatriumist vajab klooriaatom ühte elektroni juurde (klooriaatomi väliskihis on 7 elektroni).
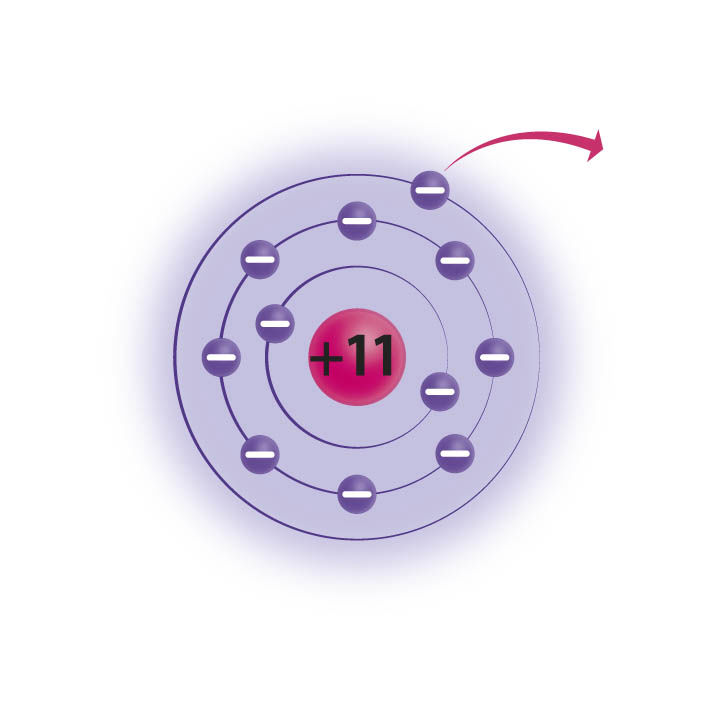 Naatrium loovutab oma väliskihi ainsa elektroni. Selle tulemusel jääb aatomi väliseks kihiks 2. elektronkiht, millel on 8 elektroni. | 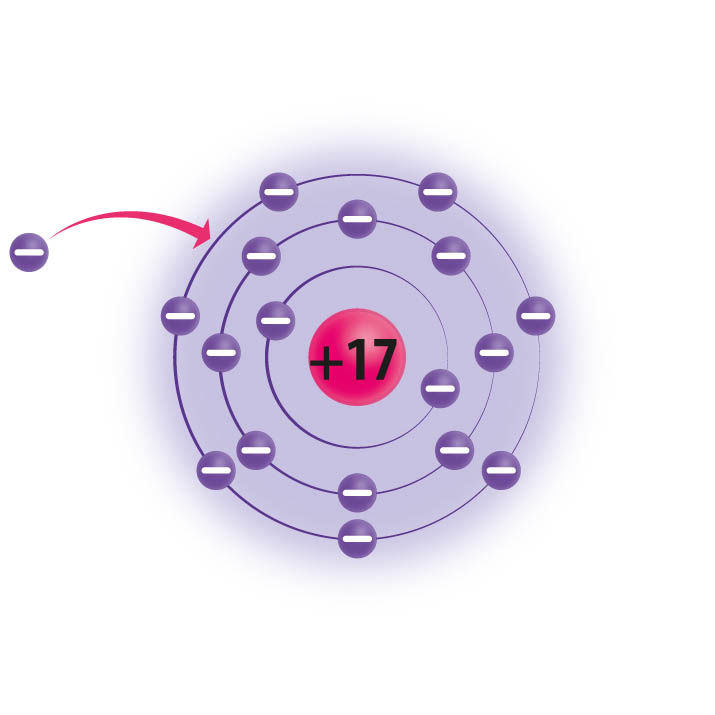 Kloor võtab juurde 1 elektroni. Selle tulemusel on aatomi välises elektronkihis 8 elektroni. |
Keemiline reaktsioon põhineb väliskihi elektronide jagamisel või ümberpaigutumisel.
Elektronokteti korral on aatomi väliskiht täielikult täitunud elektroniga. Sellise aatomi ehitusega on argoon, ksenoon ja teised . Heeliumi väliskiht on samuti täielikult täitunud, kuid selles on elektroni. Elektronokteti tõttu on need aatomid väga . Teiste elementide aatomid tahavad saavutada samuti täitunud väliskihti ning osalevad seetõttu.
Ma tean, et
- Elektronkiht on elektronkatte osa, milles liiguvad elektronid.
- Väliskiht ehk väline elektronkiht on elektronkiht, mille moodustavad aatomituumast kõige kaugemal paiknevad elektronid.
- Väärisgaasid on VIIIA rühma elemendid, mille aatomite väline elektronkiht on elektronidega täielikult täitunud.
- Elektronoktett on aatomi välise elektronkihi 8 elektroni.
Küsimused ja ülesanded
- Mitu elektroni mahub maksimaalselt 1., 2. ja 3. elektronkihti (kui see pole väline elektronkiht)?
- Mitu elektroni saab maksimaalselt väliskihis olla?
- Mille poolest on väärisgaaside aatomid erilised?
- Miks on keemilises reaktsioonis olulisemad elektronid, mitte prootonid või neutronid?