Millest maailm koosneb?
Miks paistab klaas läbi, aga paber mitte? Miks muudavad puulehed sügisel värvi? Kuigi maailm on ülimalt keeruline süsteem, toimib see kõik kindlate seaduspärasuste järgi, mida teadus püüab seletada. Keemia tõestab, et kõik meid ümbritsev – inimesed, majad, arvutid, maa – koosneb erinevatest aineosakestest: aatomitest, molekulidest ja ioonidest.

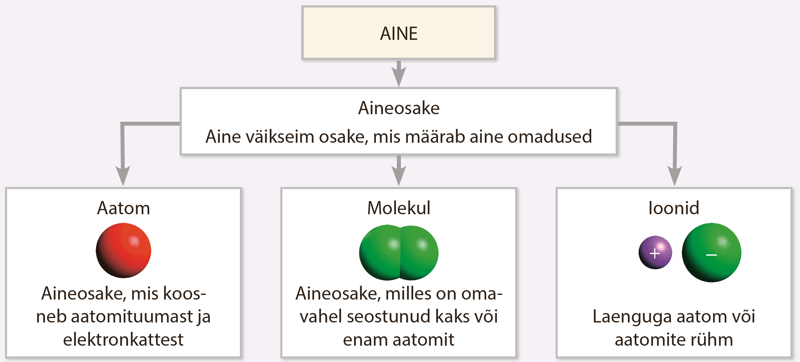
Aineosake
Aineosake on aine väikseim osake, mis määrab aine omadused. Aineosakesi on kolme liiki: aatom, molekul ja ioon.
Aatom, molekul ja ioon on aineosakesed.
Mõtle
Nimeta mõni aine, milleta poleks Maa selline, nagu me seda tunneme.
Aatom
Aatom on üliväike aineosake, mis koosneb aatomituumast ja elektronkattest. Üksikute aatomitena eksisteerivad vaid väärisgaasid. Väärisgaaside aatomid on väga püsivad, sest nende väliskiht on elektronidega täielikult täitunud (elektronoktett, vt ptk 2.2). Teiste elementide aatomid võivad püsiva oleku saavutamiseks seostuda ja moodustada kristalseid lihtaineid, mis koosnevad paljudest aatomitest. Sellised on näiteks teemant (C), räni (Si) ja metallid. Püsiva oleku saavutamiseks võivad aatomid moodustada ka molekule.

Molekul
Molekulis jagavad kaks või enam aatomit omavahel väliskihi elektrone. Sellisel juhul on aatomid saavutanud elektronidega täielikult täidetud väliskihi (vt ptk 2.2). Molekul moodustub mittemetalliliste elementide aatomite seostumisel.
Molekul on aineosake, milles on omavahel seostunud kaks või enam aatomit.
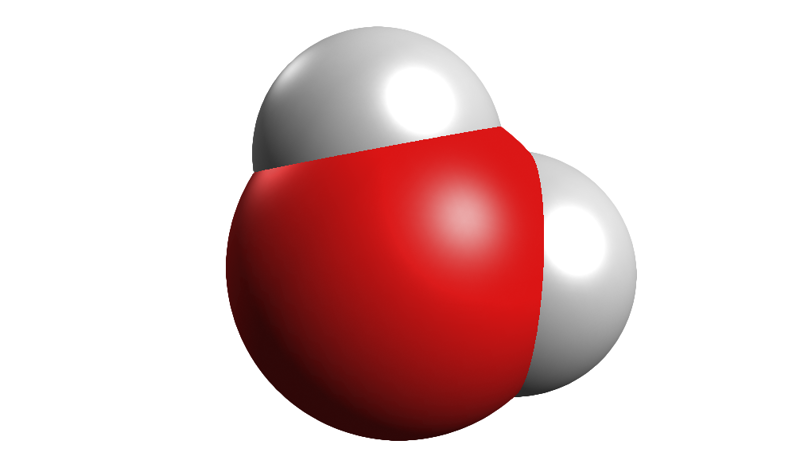
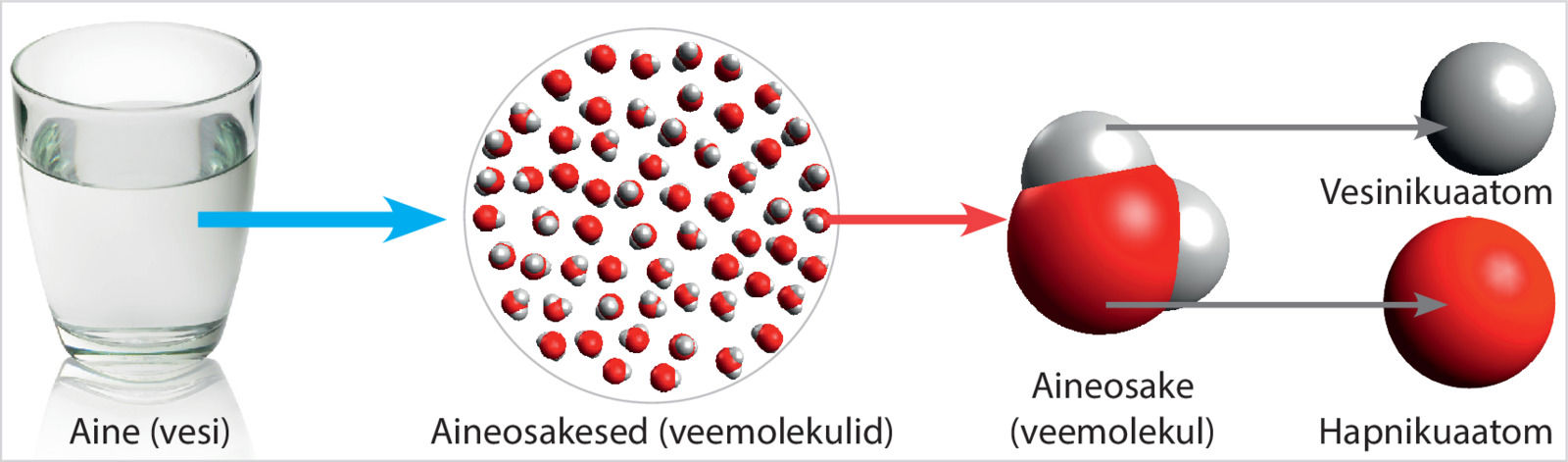
Näiteks veemolekulis on kaks vesinikuaatomit seostunud ühe hapnikuaatomiga, kloorimolekulis on omavahel seostunud kaks klooriaatomit. Molekulidest koosnevad ka inimese elutegevuseks vajalikud toitained, näiteks süsivesikud, rasvad ja valgud.
Ioon
Ioon on aineosake, mis tekib, kui aatom või aatomite rühm loovutab või liidab väliskihti elektroni(d), et saavutada püsivamat olekut ehk elektronidega täielikult täidetud väliskihti. Ioonis ei ole prootoneid ja elektrone võrdne arv ning ioon on laenguga aineosake.

Ioon on laenguga aatom või aatomite rühm.
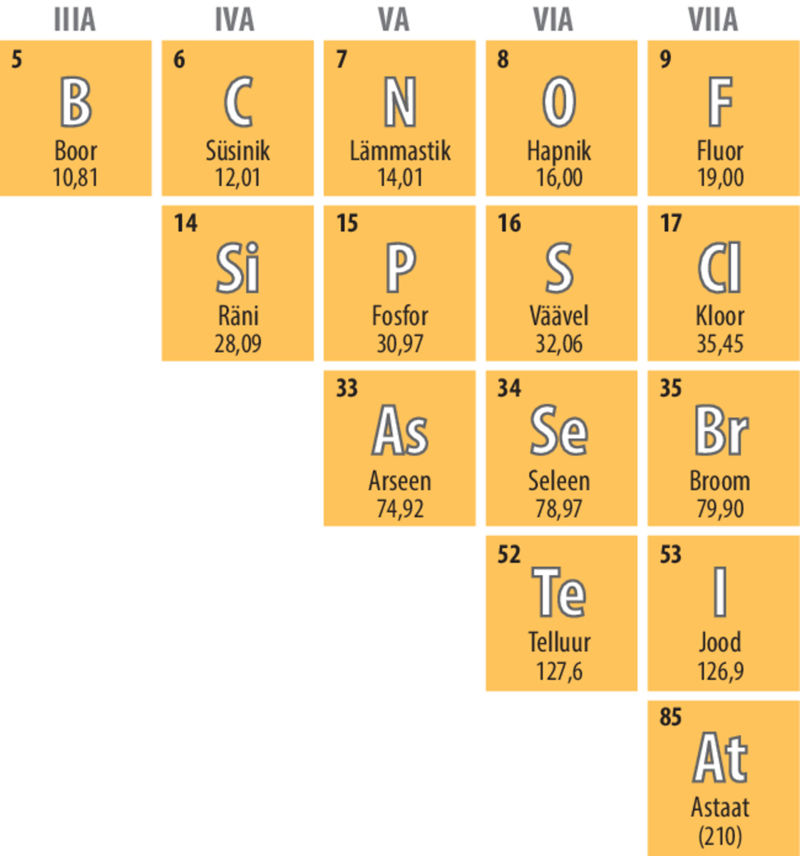
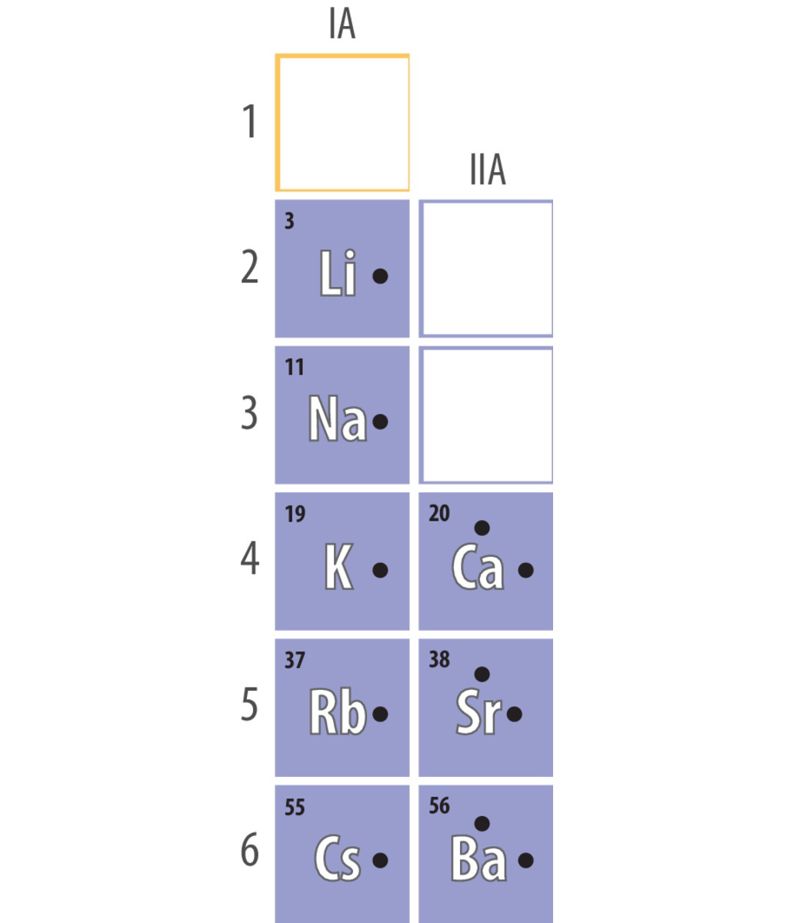
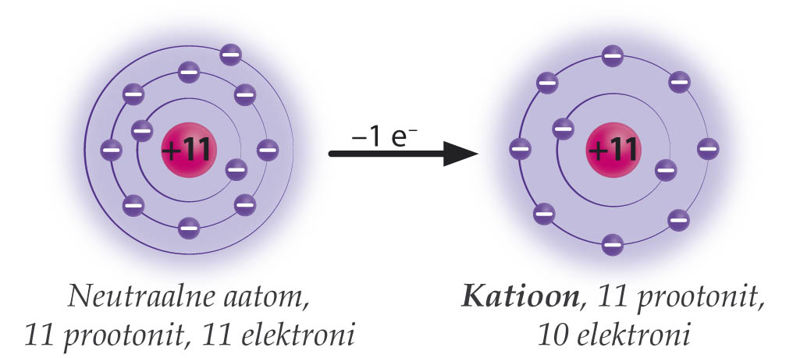
Kui aatom loovutab väliskihi elektroni(d), on tekkinud osakeses prootoneid rohkem kui elektrone ning iooni laeng on positiivne. Endine väliskiht jääb tühjaks ning uueks väliskihiks muutub eelviimane elektronkiht. Positiivse laenguga iooni nimetatakse katiooniks. Katioone moodustavad näiteks metalliliste elementide aatomid, sest nende väliskihis on vähe elektrone. Eriti aktiivsed on leelis- ja leelismuldmetallide aatomid, mille väliskihis on vastavalt 1 ja 2 elektroni, mida on aatomitel kerge loovutada.
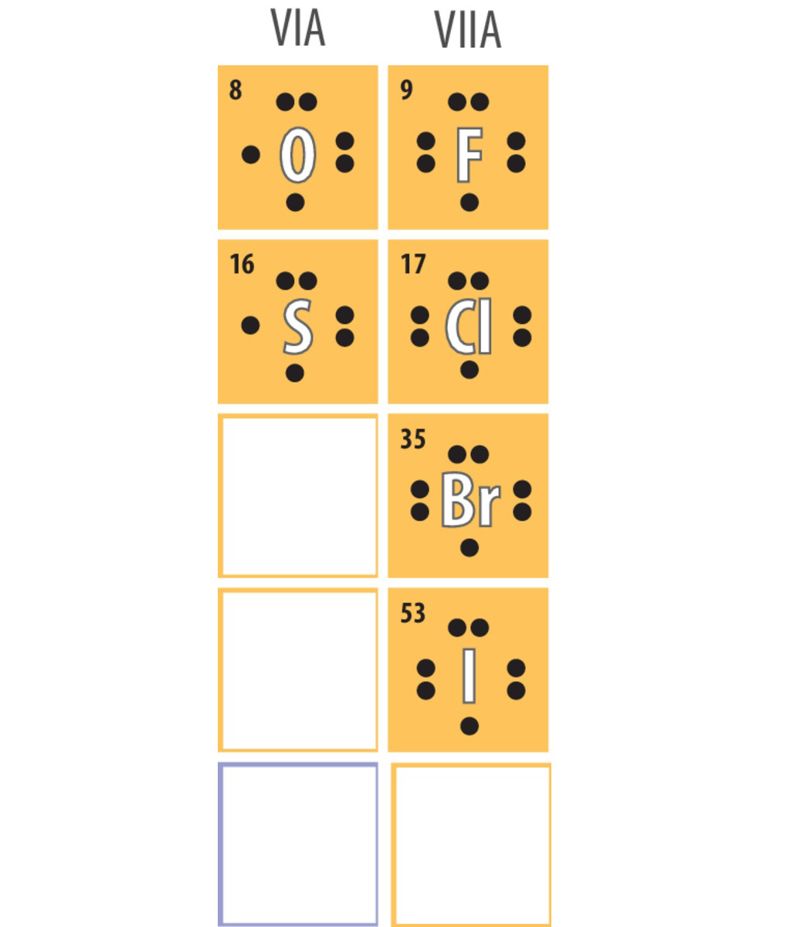
Kui aatom liidab oma väliskihti elektrone, on tekkinud osakeses prootoneid vähem kui elektrone ning iooni laeng on negatiivne. Negatiivse laenguga iooni nimetatakse aniooniks. Anioone moodustavad kergesti mittemetallilised elemendid, mille väliskihis on elektrone palju ja elektronokteti saavutamiseks on lihtne mõni elektron liita. Näiteks väävliaatomi väliskihis on 6 elektroni ning elektronokteti saavutamiseks liidab see endaga 2 elektroni. VIIA rühma mittemetallidel on väliskihis 7 elektroni ning need liidavad endaga 1 elektroni.
Iooni laeng
Aatom või aatomite rühm saab laengu, kui see loovutab või liidab elektroni(d), kuna prootonite ja elektronide arv selles pole enam võrdne.
Vaatame mõnd näidet iooni laengu leidmise kohta.
Naatriumiaatomis on 11 prootonit ja 11 elektroni. Naatriumiaatomi väliskihis on 1 elektron, mille see keemilistes reaktsioonides loovutab. Pärast elektroni loovutamist on alles 10 elektroni ning tekkinud iooni laeng on +11 − 10 = +1. Iooni laeng märgitakse vastava elemendi tähise järele ülaindeksiga, kusjuures laengu märk kirjutatakse numbri järele. Arvu 1 ei kirjutata. Nii on naatriumiooni tähis Na+.
Kaltsiumiaatom, milles on 20 prootonit ja 20 elektroni, loovutab keemilistes reaktsioonides 2 väliskihi elektroni. Tekkinud kaltsiumioonilaeng on seega +20 − 18 = +2 ning kaltsiumiooni tähis Ca2+.
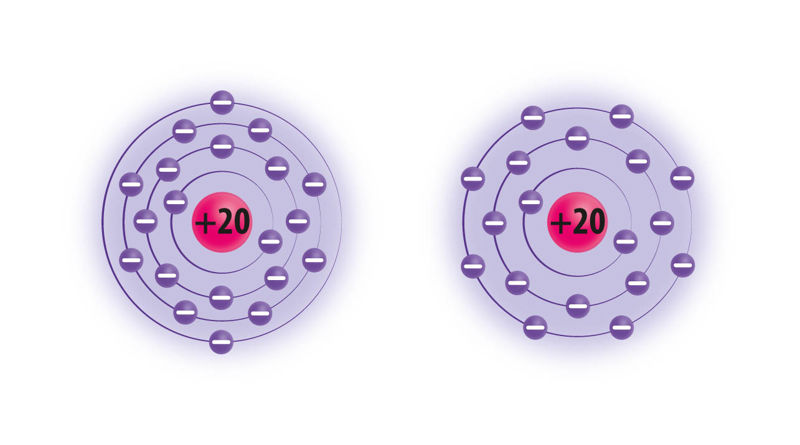
Klooriaatom, milles on 17 prootonit ja 17 elektroni, liidab ühe elektroni, kuna aatomi väliskihis on 7 elektroni. Kloriidiooni laeng on seega +17 − 18 = −1 ning tähis Cl−.
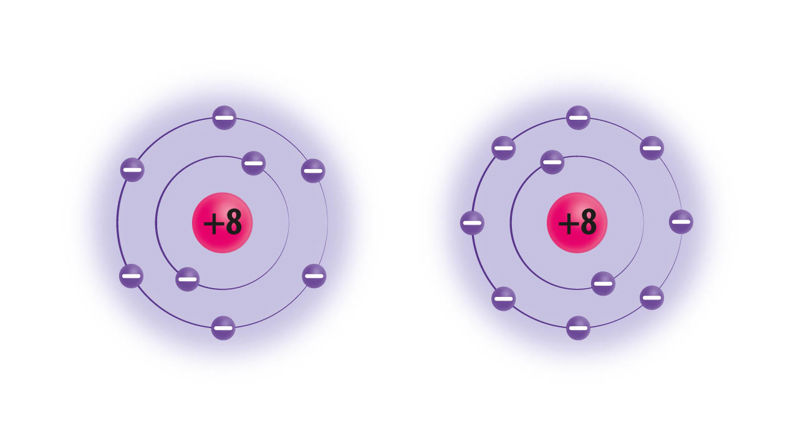
Hapnikuaatomis (vasakul) on kokku 8 prootonit ja 8 elektroni, neist väliskihis 6 elektroni. Elektronokteti saavutamiseks liidab hapnikuaatom endaga kaks elektroni ning saab laengu +8 − 10 = −2. Hapnikiooni (paremal) tähis on O2−.

Ma tean, et
- Aineosake on aine väikseim osake, mis määrab aine omadused.
- Aatom on üliväike aineosake, mis koosneb positiivse laenguga aatomituumast ja negatiivse laenguga elektronkattest.
- Molekul on aineosake, milles on omavahel seostunud kaks või enam aatomit.
- Ioon on laenguga aatom või aatomite rühm. See moodustub, kui aatom liidab või loovutab elektroni(d).
- Katioon on positiivse laenguga ioon.
- Anioon on negatiivse laenguga ioon.
Küsimused ja ülesanded
- Nimeta mõni aine, milleta poleks Maa selline, nagu me seda tunneme.
- Milliseid aineosakesi on olemas? Kirjelda neid.
- Võrdle aatomit, molekuli ja iooni. Mis on sarnane, mis erinev?