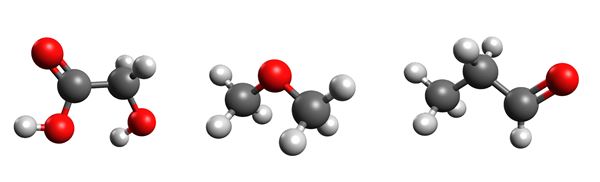
- Millist ühendit kasutavad sipelgad enesekaitseks?
- Mis hapet sisaldab äädikas?
- Mille poolest erinevad süsihape ja karboksüülhape?
Sipelghape
Sipelghape, mida leidub paljude eri liiki sipelgate mürgis, on kõige lihtsam karboksüülhape. Kõrge kontsentratsiooniga sipelghappe lahused on söövitavad ja ohtlikud, aga madala kontsentratsiooniga sipelghappe lahuseid kasutatakse palju. Näiteks lisatakse sipelghapet loomasööta, sest sipelghappe antibakteriaalne toime aitab söödal kauem säilida.

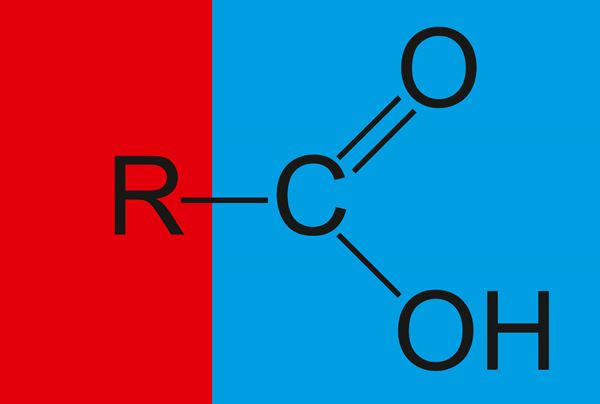
Mis on karboksüülhapped?
Karboksüülhapped (üldvalemiga RCOOH) on ühendid, mis sisaldavad karboksüülrühma (—COOH).
Karboksüülhappeks oksüdeerumine on alkoholidele väga iseloomulik reaktsioon. Näiteks oksüdeerub etanool kergesti etaanhappeks ehk äädikhappeks:
CH3CH2OH + O2 → CH3COOH + H2O
Uurime, kas karboksüülhape, näiteks etaanhape, on tüüpiline hape. Etaanhape reageerib alustega ja aluseliste oksiididega, andes vastava soola (toimub neutralisatsioonireaktsioon).
CH3COOH + NaOH → CH3COONa + H2O
2 CH3COOH + CaO → (CH3COO)2Ca + H2O
Samuti reageerib etaanhape aktiivsete ja keskmise aktiivsusega metallidega. Need tõrjuvad etaanhappest vesiniku välja.
2 CH3COOH + Zn → (CH3COO)2Zn + H2
Etaanhape põhjustab samasugust indikaatorite värvuse muutust nagu teisedki happed (vesinikkloriidhape, väävelhape), rääkimata etaanhappe hapust maitsest. Seega on etaanhappel olemas kõik hapetele iseloomulikud omadused. Etaanhape nagu teisedki karboksüülhapped on nõrk hape.
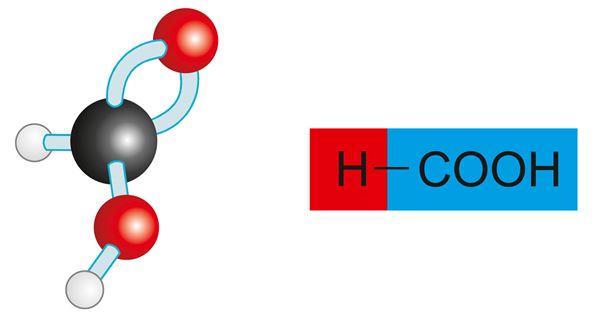
Metaanhape ehk sipelghape
Metaanhape ehk sipelghape HCOOH on lihtsaim karboksüülhape.
Metaanhape on väga terava hapu lõhnaga söövitav ja mõnevõrra mürgine vedelik, mis seguneb veega. Looduses leidub teda sipelga- ja mesilasemürgis ning nõgese kõrvekarvakestes.

Metaanhape on ...
- tuntud ka kui äädikhape.
- tuntud ka kui sipelghape.
- hapu.
- plahvatusohtlik.
- söövitav.
- lõhnatu.
- tugev hape.
- gaasiline aine.
Etaanhape
Etaanhape ehk äädikhape CH3COOH on kõige tuntum karboksüülhape. See on iseloomuliku hapu lõhnaga söövitav vedelik, mis tahkub toatemperatuuri lähedal (17 ºC) ning seguneb veega. Etaanhape tekib etanooli lahjade lahuste äädikhapekäärimisel, s.t etanooli oksüdeerumisel bakterite toimel.
Etaanhape ei ole mürgine, lahja lahusena kasutatakse teda toidu maitsestamiseks ja konserveerimiseks (marineerimiseks). Etaanhapet leidub organismides ning sel on ainevahetuses tähtis osa.
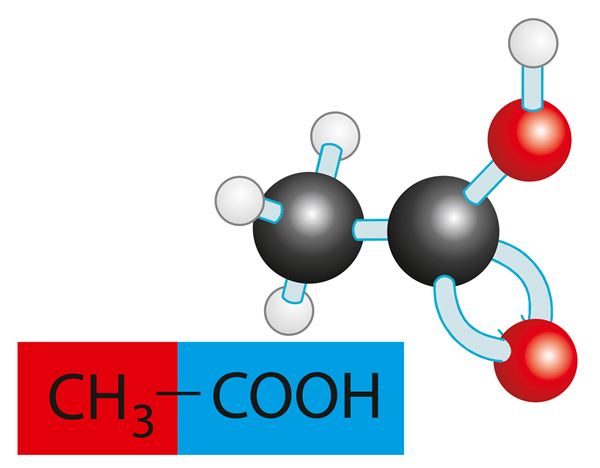
Etaanhape on ...
- tuntud ka kui äädikhape.
- tuntud ka kui sipelghape.
- hapu.
- mürgine.
- söövitav.
- tugeva lõhnaga.
- tugev hape.
- gaasiline aine.
Süsihappe ja karboksüülhappe võrdlus
Võrdleme süsihappe struktuuri ja omadusi mõne karboksüülhappe, näiteks etaanhappe struktuuri ja omadustega.
Näeme, et süsihappe ja etaanhappe struktuur on üsna sarnane, etaanhappes on ainult teise —OH-rühma asemel —CH3-rühm. See muudab etaanhappe palju püsivamaks. 100%-line etaanhape (jää-äädikhape) on täiesti püsiv ega lagune ka destilleerimisel.
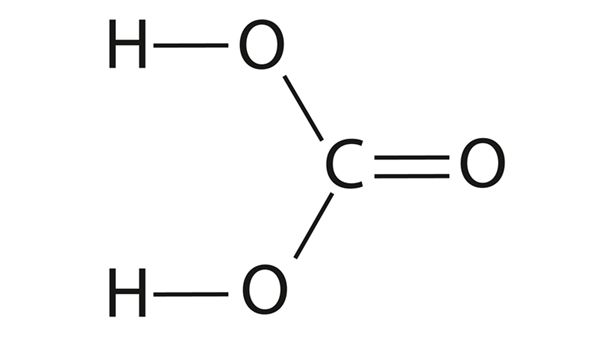
- Süsihape
- Äädikhape
- laguneb kuumutamisel.
- ei lagune kuumutamisel.
Mõtlemist
Kas süsihape võiks kuuluda karboksüülhapete hulka? Põhjenda.
Levinud karboksüülhapped
Mõned olulised, kuid keerukama struktuuriga karboksüülhapped.
- Piimhape tekib käärimisel (piima hapnemisel) piimasuhkrust.
- Bensoehape ja salitsüülhape on mikroorganismidevastase toimega, kuid inimesele need kahjulikud pole. Need on valged, kristalsed, vees vähe lahustuvad ained, mida leidub paljudes marjades (pohlad, jõhvikad).
- Sidrunhapet, nagu nimigi näitab, leidub sidrunites, aga ka apelsinides. See on valge kristalne aine, mis on väga puhta ja meeldiva hapuka maitsega ning seda kasutatakse kondiitritööstuses.
- Oblikhape sisaldub oblikates, rabarbris ja jänesekapsas. Suuremas koguses on oblikhape natuke mürgine.
Kõik need karboksüülhapped on tüüpilised happed. Nad reageerivad alustega, andes sooli. Pika süsinikuahelaga (16 ja 18 süsiniku aatomit) karboksüülhappeid nimetatakse rasvhapeteks. Rasvhapete soolad on seebid.
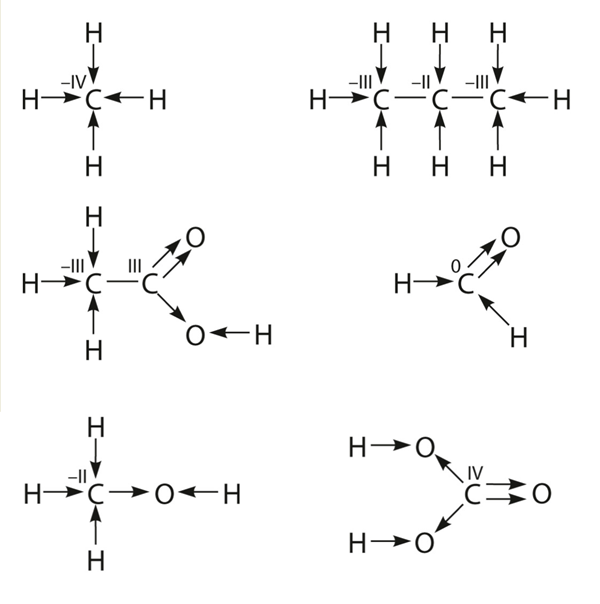
Süsiniku oksüdatsiooniastmete arvutamine
Siiani oleme süsiniku oksüdatsiooniastme (o-a) määranud tavalisel viisil, nagu õppisime VIII klassis. Mitme süsiniku aatomiga molekulis võivad aga nende oksüdatsiooniastmed olla erinevad ning arvutatud o-a on tegelike oksüdatsiooniastmete keskmine väärtus. Mõnes ühendis võib summaarsest valemist arvutatud o-a tulla isegi murdarvuline (näiteks propaani puhul on süsiniku o-a –2,67). See on vastuolus o-a definitsiooniga: iooni laeng peab olema täisarvuline. Ometi on keskmist o-a vaja arvutada näiteks kütteväärtuste puhul (vt ptk 6.3).
Muidugi on vaja osata arvutada o-a ka iga süsiniku aatomi jaoks eraldi. Seda võib teha tavalisel viisil, aga ka teistmoodi. Märgime struktuurivalemis iga sideme noolega, mille teravik tähistab laengut –1, saba laengut +1. Ühesuguste aatomite vahelise tavalise kriipsu otsad tähistavad laengut 0. Liidame iga aatomi ümber noolte otsad ja sabad ning o-a ongi käes. Paneme tähele, et süsiniku aatom võib olla korraga seotud nii positiivsete (sh 0) kui ka negatiivsete oksüdatsiooniastmetega aatomitega.
Mõtlemist
Millises süsinikuühendis on süsiniku oksüdatsiooniaste –I või I?
Mõtlemist
Kumma, kas põlevkivi või maagaasi kütteväärtus on kõrgem?
Ma tean, et ...
- Karboksüülhapped (üldvalem RCOOH)
- tekivad alkoholide oksüdeerumisel;
- sisaldavad karboksüülrühma —COOH;
- on tüüpilised, kuid nõrgad happed.
Küsimused ja ülesanded
- Miks sipelgad ja mesilased toodavad metaanhapet?
- Kas süsihape võiks kuuluda karboksüülhapete hulka? Põhjenda.
- Kuidas kindlaks teha, kas etaanhape on tugevam või nõrgem hape kui väävelhape?
- Nimeta puuvilju ja marju, mis sisaldavad suurel hulgal karboksüülhappeid.
- Mitu oksüdatsiooniastet on süsinikul?