Aatom on keemilise elemendi [mõiste: keemiline element – aine, mida ei saa keemiliste meetoditega lihtsamateks aineteks lahutada]väikseim osake, millel on kõik selle elemendi keemilised omadused. Aines võivad aatomid olla üksikult või molekulideks liitununa. Aatomid on väga väikesed, nende läbimõõt on suurusjärgus 1 ongström (1 Å), mis on . Kui panna aatomid tihedalt üksteise kõrvale ritta, siis 1 cm pikkuse rea moodustamiseks läheks vaja 100 miljonit aatomit.
Aatomimudel
Kuna aatomid on väga väikesed, siis pole neid võimalik detailselt näha ka kõige võimsamate mikroskoopidega. On küll saadud pilte tahkise[joonealune: aine tahkes olekus, milles molekulid paiknevad kindla korra järgi] pinnast, kus võib eristada aatomeid, kuid see on seni kõik. Näiteks on pildistatud grafiidi [joonealune: süsiniku kristalne vorm, milles aatomid paiknevad korrapäraste kuusnurkadena]pealispinda, mis sarnaneb munarestis olevate munadega, aga iga „muna“ on tegelikult üks süsiniku aatom.
Kuna aatomeid pole võimalik näha, siis on nende kirjeldamiseks loodud mudelid[mõiste: mudel – originaali ligilähedane koopia, kus on säilitatud originaali kõik põhilised tunnused]. Neid on olnud läbi aegade mitmesuguseid. Meie vaatleme neist kolme: planetaarne mudel, Bohri mudel ja tänapäevane mudel.
Mõtle!
- Kuidas saadi tunnelmikroskoobiga pilt grafiidi pinnast?
Planetaarmudel
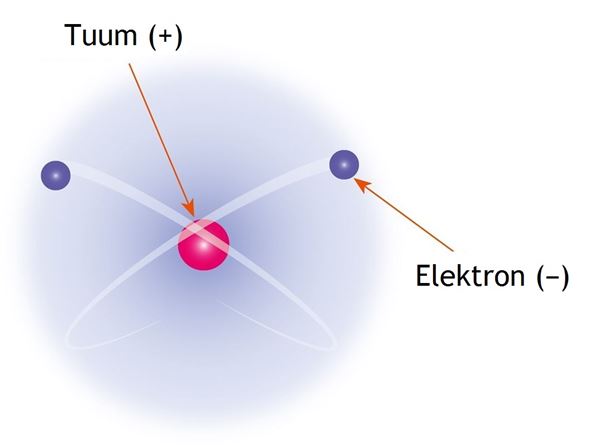
Selle mudeli mõtles 1911. aastal välja Inglise füüsik Ernest Rutherford, kes võttis aluseks aatomi ehituse sarnasuse Päikesesüsteemiga. Planetaarmudeli kohaselt asub aatomi keskel positiivse laenguga tuum, mille ümber tiirlevad negatiivse laenguga elektronid. Selle mudeli puhul tekkis aga üks põhimõtteline vastuolu: kui elektron tiirleb, siis tuleb tal oma liikumissuuna muutmiseks tööd teha, mistõttu peaks elektroni energia vähenema. Arvutused näitasid, et u jooksul peaks elektron kukkuma tuuma ja aatom hävima. See mudel andis küll mingi ettekujutuse aatomi ehitusest, kuid ei olnud täiesti korrektne.
Bohri aatomimudel
1913. aastal esitles Taani füüsik Niels Bohr oma aatomimudelit, mis tugines vesiniku kiirgusspektri analüüsile. Planetaarse aatomimudeli vastuolust, mis seisnes selles, et elektroni energia väheneb, sai Bohr jagu, väites, et on olemas sellised orbiidid[mõiste: orbiit – elektroni liikumistee aatomi tuuma ümber], kus elektronid saavad liikuda energiat kaotamata. Ühtlasi andis ta seletuse ka valguse kiirgumise ja neeldumise kohta aatomis. Kui elektron saab energiat juurde, st valgus neeldub aatomis, siis liigub elektron tuumast kaugemal asuvale orbiidile. Kui aga elektron tuleb tuumale lähemal olevale orbiidile, siis tema energia väheneb ja energia ülejääk kiirgub valgusena aatomist välja.
Aatom ei saa neelata ja kiirata igasuguse värvusega valgusi, vaid ainult selliseid, mille energia vastab täpselt mingi kahe orbiidi energiate vahele. See tähendab, et valgus neeldub ja kiirgub aatomis kindlate portsjonite ehk kvantide kaupa.
Bohri teooria oli uus samm füüsikas, sest see seletas hästi ära vesiniku kiirgus- ja neeldumisspektrite tekkimise. Paraku ei olnud Bohri aatomimudel ja eksperimendi tulemused raskemate elementide kiirguse korral enam nii heas kooskõlas. Sellepärast jätkati aatomite ehituse uurimist.
Mõtle!
- Kuidas on valguse kiirgumine ja neeldumine aatomites seotud meie võimega kehasid näha?
Elektron liigub tuumale lähemale −
Elektron liigub tuumast kaugemale −
Lisalugemine. Bohri postulaadid
Bohri teooria aluseks on tema püstitatud postulaadid[mõiste: postulaat – mingi teooria aluseks võetav väide, mille kehtivust tunnistatakse ilma tõestuseta].
- Lõpmatust hulgast ringikujulistest elektroni orbiitidest, mis on klassikalise mehaanika reeglite järgi võimalikud, realiseerub vaid osa kindlale energiale vastavaid orbiite. Need on nn statsionaarsed orbiidid, kus elektron tiirleb energiat kiirgamata.
- Ajal, mil elektron läheb ühelt statsionaarselt orbiidilt teisele üle, aatom kas kiirgab või neelab kindla sagedusega elektromagnetilist kiirgust.
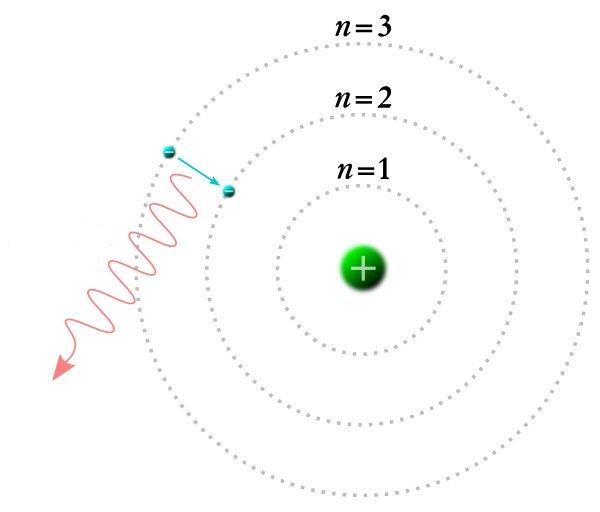
Seega väitis Bohr, et kui aatom neelab kiirgust, siis siirdub mõni elektron tuumast kaugemale statsionaarsele orbiidile. Kui elektron liigub tuumale lähemal olevale statsionaarsele orbiidile, siis aatom kiirgab elektromagnetilist kiirgust.
Tänapäevane aatomimudel
Tänapäevase aatomimudeli kohaselt asub aatomi keskel endiselt positiivselt laetud tuum ja selle ümber liiguvad negatiivselt laetud elektronid. Tuuma positiivne laeng on tingitud prootonitest, osakestest, mille laeng on elektroni laenguga võrdne, aga vastasmärgiline, seega positiivne. Aatomis on elektrone ja prootoneid võrdne arv.
Elektronid kihutavad tohutu kiirusega risti-rästi ümber tuuma, mistõttu ei ole võimalik kasutada orbiidi mõistet. Räägitakse hoopis elektronpilvest[mõiste: elektronpilv – piirkond tuuma ümber, kust võib elektroni leida], mis on piirkond tuuma ümber, kust võib elektroni leida. Kusjuures pilve erinevates osades on elektroni leidmise tõenäosus[joonealune: näitab sündmuse toimumise võimalikkust protsentides; kui sündmus toimub alati, on tõenäosus 100%, kui ei toimu iialgi, on tõenäosus 0%] erinev. Pilve kuju ja mõõtmed määrab ära elektroni energia, mistõttu on igal pilvel erinev kuju ja suurus, mis muutuvad, kui muutub elektroni energia.

Mõtle!
- Milliseid osakesi peale elektroni ja prootoni aatomis veel leidub?
Jätan meelde
- Kuna aatomeid pole võimalik näha, siis on nende kirjeldamiseks loodud mudelid.
- Aatomi planetaarmudel sarnaneb Päikesesüsteemiga.
- Bohri mudel andis selgituse valguse kiirgumisele ja neeldumisele aatomis.
- Tänapäevase aatomimudeli järgi asub elektron elektronpilves, st piirkonnas tuuma ümber, mille eri osadest võib elektroni erineva tõenäosusega leida.