Liitainete tekkimine
Lihtaineid on looduses üpris vähe. Metsast või kaevanduskarjäärist ei leia puhast rauda ega alumiiniumi, rääkimata väga reageerimisvõimelisest naatriumist. Need ja enamiku teiste elementide lihtained reageerivad teiste ainetega, peamiselt hapnikuga, ning moodustavad ühendeid ehk liitaineid.

Ühinemisreaktsioon
Aatomid soovivad saavutada püsivat olekut, kus neil oleks võimalikult madal energia. Aatomid reageerivad omavahel, et saavutada täielikult täidetud väline elektronkiht (vt ptk 2.2). Nii ühinevad omavahel metalli- ja mittemetalliaatomid, aga ka mitmesugused mittemetallid. Ainete liitumine on ühinemisreaktsioon.
Ühinemisreaktsioon on keemiline reaktsioon, milles ained omavahel ühinevad ning moodustavad uue aine.

- C + O2 → CO2
- CaCO3 → CaO + CO2
Lihtaine põlemisreaktsioon kui ühinemisreaktsioon
Mittemetallide põlemisel tekivad mittemetallioksiidid. Näiteks vesi kui tavatingimustes vedel oksiid tekib kahe vesinikumolekuli (H2) ja ühe hapnikumolekuli (O2) ühinemisel. Teaduskeskuses Ahhaa demonstreeritakse seda reaktsiooni plahvatusega, selleks süüdatakse nende gaaside segu.
Väävel on kollane tahke aine, mida leidub tihti vulkaanilistes piirkondades. Väävli põlemisel tekib mürgine vääveldioksiid (SO2).
Metallide põlemisel tekivad metallioksiidid. Leelis- ja leelismuldmetallid reageerivad hapnikuga väga kergesti.
Alumiiniumist detailid, nt foolium või ehitusdetailid, ei põle, ent pulbristatud alumiinium põleb ereda leegiga ning tekib alumiiniumoksiid (Al2O3).
Samamoodi kui alumiinium, põleb ka rauapulber. Rauapulbri põlemisel tekivad sädemed ja tavaliselt annabki säraküünaldele sädeluse rauapulber. Säraküünla sädemed on peamiselt väikesed põlevad rauatükid, mis lendavad laiali hapnikku sisaldavate ühendite lagunemisreaktsioonil tekkivate gaaside mõjul.
- Mittemetalli ühinemisel hapnikuga tekib metallioksiid.
- Vesiniku põlemissaadus on vesi.
- Leelismetallid hapnikuga ei reageeri.
- Alumiinium- ja rauapulber põlevad leegiga.
Reaktsioonivõrrandi koostamine ja tasakaalustamine
Reaktsioonivõrrandite koostamine algab reaktsioonis osalevate ainete valemite kirjapanemisega. Näiteks reageerivad omavahel vesinik ja hapnik ning tekib vesi.
Keemilistes reaktsioonides kehtib aine massi jäävuse seadus, mistõttu aatomite koguarv reaktsiooni käigus ei muutu. Seega peab reaktsioonivõrrandi vasakul poolel olema ühe elemendi aatomeid sama palju kui paremal poolel. Seetõttu tuleb elementide aatomite arvud reaktsioonivõrrandi vasakul ja paremal poolel võrdsustada ehk tasakaalustada. Selleks kirjutatakse ainete valemite ette kordajad.

Vee tekkereaktsiooni näites on praegu nii võrrandi vasakul kui ka paremal poolel 2 vesinikuaatomit, kuid hapnikuaatomeid on vasakul poolel 2 ja paremal 1. Selleks, et ka võrrandi paremal poolel oleks 2 hapnikuaatomit, tuleb kordaja 2 kirjutada veemolekuli ette.
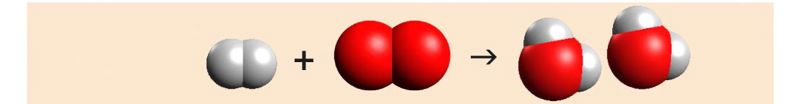
Nüüd on hapnikuaatomite arv võrdne, ent vesinikuaatomeid on võrrandi paremal poolel kaks korda rohkem. Reaktsioonivõrrandi tasakaalu viimiseks tuleb lisada võrrandi vasakule poolele vesiniku ette kordaja 2.
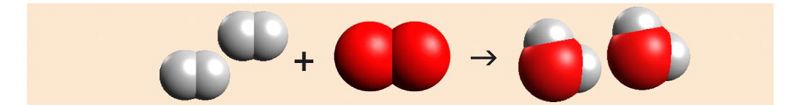
Leitud kordajatega võrrand on tasakaalus: vesinikuaatomeid on nii lähteainete kui ka saaduste poolel 4, hapnikuaatomeid on mõlemal poolel 2.
Mõtle
Miks on vaja reaktsioonivõrrandeid tasakaalustada?
Ma tean, et
- Ühinemisreaktsioon on keemiline reaktsioon, milles ained omavahel ühinevad ning moodustavad uue aine. Ühinemisreaktsioon on näiteks lihtainete põlemine.
- Reaktsioonivõrrandi tasakaalustamine on aatomite arvu võrdsustamine reaktsioonivõrrandi vasakul (lähteainete) ja paremal (saaduste) poolel.
- Reaktsioonivõrrandi kordaja on suurus, mis näitab aineosakeste arvu või arvude suhet reaktsioonis.
Küsimused ja ülesanded
- Mitu saadust on ühinemisreaktsioonil?
- Miks on vaja reaktsioonivõrrandeid tasakaalustada?
- Too üks näide metallilise ja mittemetallilise lihtaine ning üks näide kahe mittemetallilise lihtaine ühinemisreaktsiooni kohta.
- Kirjuta ja tasakaalusta äikese põhjustatud hapniku ja lämmastiku ühinemisreaktsioon.