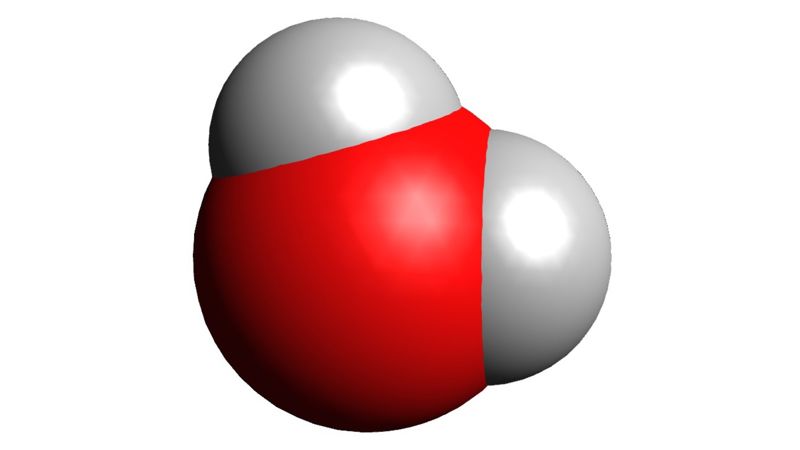
- Mis aine on divesinikoksiid?
- Kuidas liigitatakse oksiide nende koostise põhjal?
- Kuidas saadakse oksiide?
- Millised oksiidid reageerivad veega?
Kuhu kaovad korallid?
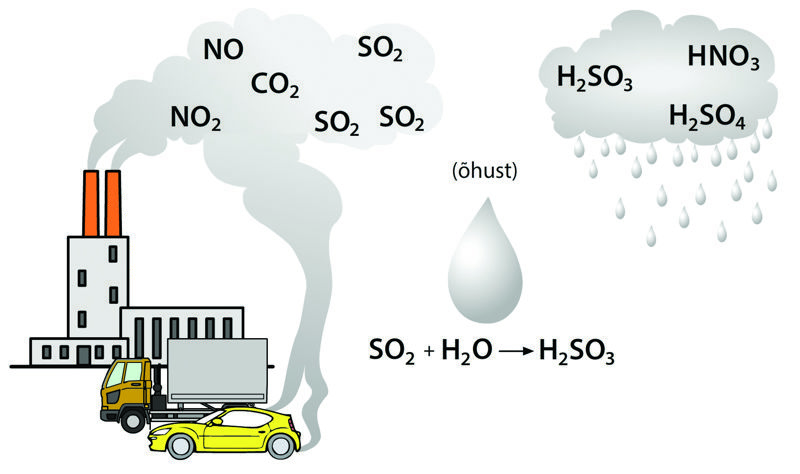
Inimeste tegevuse tagajärjel lahustub ookeanivees üha rohkem süsihappegaasi ehk süsinikdioksiidi, mis põhjustab ookeani hapestumist. Süsinikdioksiid reageerib lahustumisel osaliselt veega ning moodustab süsihappe. Hape annab lahusesse vesinikioone ja muudab vee keskkonna happelisemaks, seetõttu halvenevad oluliselt mitmesuguste organismide elutingimused. Ookeani hapestumine raskendab korallidel ja teistel organismidel kõva kesta ehitamist ning korallide skelett lahustub kiiremini, kui see tekkida jõuab.

Oksiidi mõiste, liigitamine ja nimetamine
Õhu koostises olev hapnik reageerib kergesti enamiku ainetega (v.a väärisgaasid ja mõned väärismetallid) ning moodustuvad oksiidid. Oksiidid on ühed levinumad ühendid looduses.
Oksiid on liitaine, milles hapnikuaatom on seostunud mõne teise elemendi aatomiga.
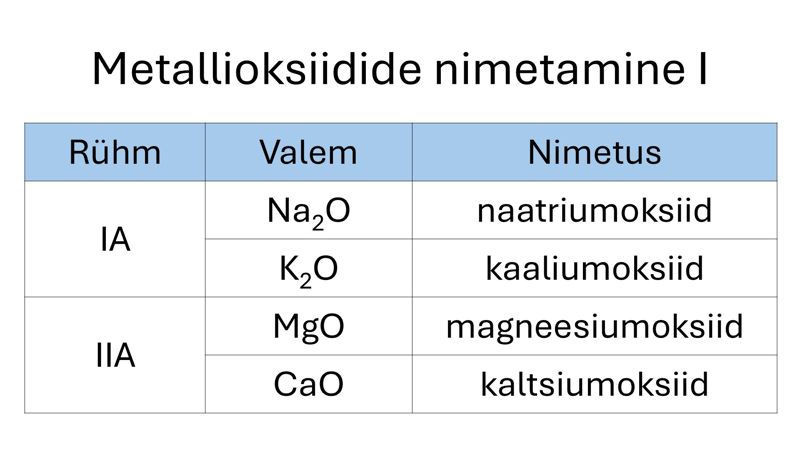
Oksiide liigitatakse nende koostise põhjal mittemetalli- ja metallioksiidideks.
Mittemetallioksiid on liitaine, milles hapnikuaatom on seostunud mittemetallilise elemendi aatomiga.

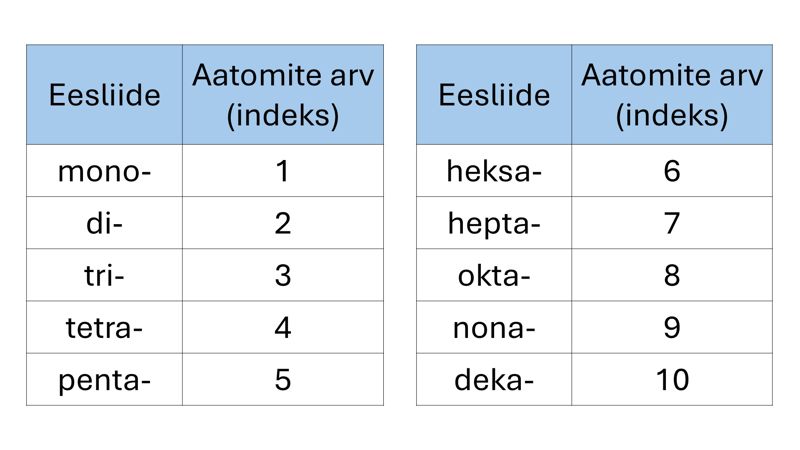
Mittemetallioksiidide nimetustes kasutatakse peamiselt kreeka ja ladina keelest tuletatud eesliiteid, millega märgitakse aine valemis olevate aatomite arv. Eesliidet mono-, mis väljendab ühte aatomit aineosakeses ehk indeksit 1, nimetuses tavaliselt ei kasutata.
CO – süsinikoksiid
SO2 – vääveldioksiid
P4O10 – tetrafosfordekaoksiid
Eesliited
Metallioksiid on liitaine, milles hapnikuaatom on seostunud metallilise elemendi aatomiga.
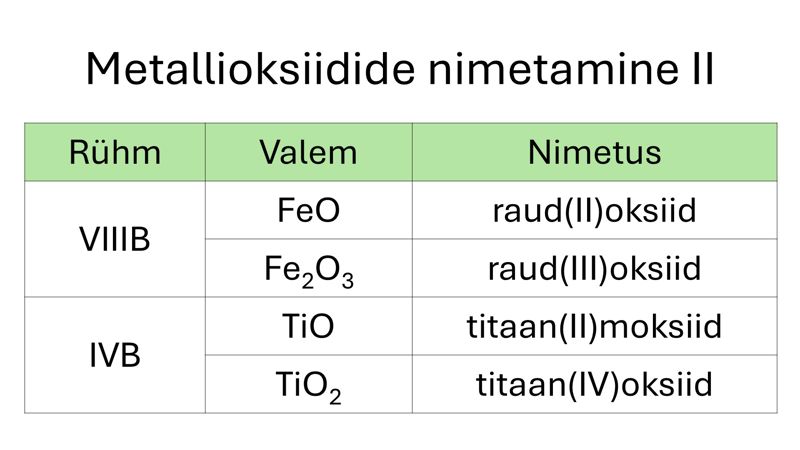
Metallioksiide nimetatakse peamiselt metallilise elemendi oksüdatsiooniastme abil. Kui metallilise elemendi aatomil on ühendites vaid üks võimalik oksüdatsiooniaste (IA ja IIA rühma metallid, Al ja Zn), lisandub metalli nimetusele vaid järelliide -oksiid. Kui metallilise elemendi aatom moodustab ühendeid mitmes erinevas oksüdatsiooniastmes, kirjutatakse oksiidi nimetuses metalli nimetuse ja järelliite -oksiid vahele sulgudesse metalliaatomi oksüdatsiooniaste.
Oksiidide saamine
Paljusid oksiide on võimalik saada lihtaine ühinemisreaktsiooni käigus hapnikuga (O2). Hapnikuga ühinedes lihtaine aatomid enamasti oksüdeeruvad ja loovutavad elektrone hapnikuaatomitele.
Kui hapnikuga reageerib mittemetall, on saaduseks mittemetallioksiid. Näiteks süsiniku põlemise saaduseks on süsinikdioksiid.
C + O2 → CO2
Väävel on kollane pulber, mis põleb õhuhapniku toimel sinise leegiga, reaktsiooni saaduseks on gaasiline vääveldioksiid.
S + O2 → SO2
Punast fosforit kasutatakse tikutoosi süütepinna koostises. Fosfori põlemise saaduseks on tetrafosfordekaoksiid.
P + O2 → P4O10

Kui hapnikuga reageerib metall, on tavaliselt saaduseks metallioksiid.
Na + O2 → Na2O
Fe + O2 → Fe2O3
Väheaktiivsed metallid on hapniku suhtes väga püsivad. Näiteks väärismetallid (kuld, hõbe, plaatina jt) ei reageeri hapnikuga ei toatemperatuuril ega ka kuumutamisel.
Oksiidide keemilised omadused
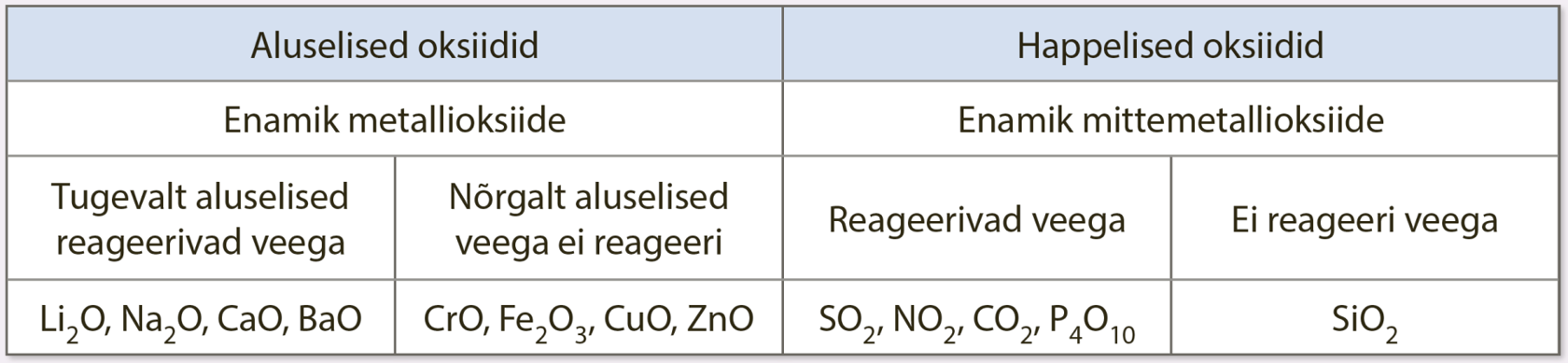
Oksiidid on mitmesuguste keemiliste omadustega: on keemiliselt väga aktiivseid oksiide, ent on ka väga püsivaid. Enamik oksiide liigitatakse nende keemiliste omaduste põhjal happelisteks ja aluselisteks.
Happelised oksiidid
Happelised oksiidid on happeliste omadustega. Sellised on enamik mittemetallioksiide. Kui happeline oksiid reageerib veega, tekib hape.
Happelise oksiidi reageerimisel veega tekib hape.
Näiteks kui gaasiline mittemetallioksiid CO2, SO2 või SO3 reageerib veega, tekib vastav hape.
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Lämmastikdioksiidi reaktsiooni käigus veega tekib lämmastikhape ja lämmastikushape.
NO2 + H2O → HNO3 + HNO2
Lämmastikhapet saab siis, kui dilämmastikpentaoksiid reageerib veega.
N2O5 + H2O→ 2HNO3
Tetrafosfordekaoksiidi reaktsioonis veega tekib fosforhape.
P4O10 + H2O → H3PO4
Osa nõrgalt happelisi oksiide veega ei reageeri ja hapet ei anna. Sellegipoolest on neile vastavad happed olemas. Üks selliseid on tahke ränidioksiid (SiO2), millele vastav hape on H2SiO3.
SiO2 + H2O → ei toimu

Aluselised oksiidid
Aluselised oksiidid on aluseliste omadustega. Sellised on enamik metallioksiide, mis on tahked ioonidest koosnevad ained. Aktiivsete leelis- ja leelismuldmetallide (IA rühma ja IIA rühma metallid alates Ca) oksiidid on tugevalt aluselised. Tugevalt aluselised oksiidid reageerivad veega väga kiiresti ja saadusena tekib vastav tugev alus ehk leelis ning eraldub palju soojust.
Tugevalt aluselise oksiidi reageerimisel veega tekib leelis.
Na2O + H2O → NaOH
CaO + H2O → Ca(OH)2
Vähemaktiivsete metallide oksiidid, näiteks FeO, CuO ja CrO, on nõrgalt aluselised ning veega ei reageeri. Sellistele oksiididele vastavad hüdroksiidid on nõrgad alused.
CuO + H2O → ei toimu
Kuigi need nõrgalt aluselised oksiidid veega ei reageeri, on neile vastavad hüdroksiidid (alused) olemas. Sellised on näiteks Fe(OH)2 ja Cu(OH)2.

Ma tean, et ...
- Oksiid on liitaine, milles hapnikuaatom on seostunud mõne teise elemendi aatomiga.
- Oksiide liigitatakse koostise põhjal mittemetallioksiidideks ja metallioksiidideks.
- Paljusid oksiide on võimalik saada lihtaine ühinemisreaktsiooni käigus hapnikuga.
- Enamik mittemetallioksiide on happelised oksiidid. Happelise oksiidi reageerimisel veega tekib hape.
- Enamik metallioksiide on aluselised oksiidid. Tugevalt aluselise oksiidi reageerimisel veega tekib tugev alus ehk leelis.
Küsimused ja ülesanded
- Mille poolest erinevad mittemetalli- ja metallioksiid?
- Kuidas nimetatakse mittemetallioksiide, kuidas metallioksiide?
- Seleta, kuidas tekivad oksiidid.
- Otsi internetist, mis on rauatagi keemiline nimetus ja kuidas see tekib.
- Kas SO2 ja FeO on happelised või aluselised oksiidid? Põhjenda oma vastust.