Happed meie kehas
Laboris kasutatakse hapetega töötades kaitsevahendeid, sest happed võivad kahjustada tervist. Samas on ka meie kehas happeid, millel on täita väga tähtis roll. Näiteks inimese maomahla komponent soolhape (HCl) kiirendab toitainete lagunemist seedeprotsessis. Kogu meie pärilikku infot säilitab aga desoksüribonukleiinhape ehk DNA.

Happe tunnuseid
Üks happe tunnuseid on hapukas maitse, selle järgi on happed ka oma nimetuse saanud. Tsitruselised (sidrun, laim, apelsin) on hapud, sest sisaldavad näiteks sidrunhapet. Keefir, hapukoor ja jogurt sisaldavad näiteks piimhapet. Toitude maitsestamiseks ja hoidiste valmistamiseks kasutatakse söögiäädikat, mille komponendiks on äädikhape. Paljud happed on söövitavad ja tekitavad raskeid tervisekahjustusi. Seetõttu ei tohi laboris kunagi happeid kindlaks teha neid maitstes!

Hapete söövitava toime tõttu võivad need nahale sattudes tekitada söövitushaavu. Osa happeid võib mõnesse materjali augu söövitada.
- Happed on hapuka maitsega.
- Kõik happed on ohutud toiduainetes sisalduvad ained.
- Happeid ei tohi laboris maitsta.
- Happed võivad olla söövitavad.
- Happed võivad kahjustada nahka, aga mitte riideid.
- Hapetega töötades tuleb kasutada kaitsevahendeid ja järgida ohutusnõudeid.
Hapete koostis
Ainete omadused määrab nende koostis. Happeid on mitmesuguseid, ent siin käsitleme happeid, mille molekuli koostisesse kuulub vähemalt üks vesinikuaatom. Tuntumate hapete valemid ja nimetused on esitatud tabelis.
Tuntumate hapete valemid ja nimetused
Valem |
Nimetus |
HCl |
Vesinikkloriidhape ehk soolhape |
HNO3 |
Lämmastikhape |
H2SO4 |
Väävelhape |
H2SO3 |
Väävlishape |
H2S |
Divesiniksulfiidhape |
H2CO3 |
Süsihape |
H2SiO3 |
Ränihape |
H3PO4 |
Fosforhape |
Happemolekulid jagunevad vesilahustes positiivselt laetud vesinikioonideks ja negatiivselt laetud anioonideks (vt ptk 3.1). Sõltuvalt happest jaguneb ioonideks erinev osa happemolekulidest. Hapete omadused ongi põhjustatud hapete lahustes esinevatest vesinikioonidest.
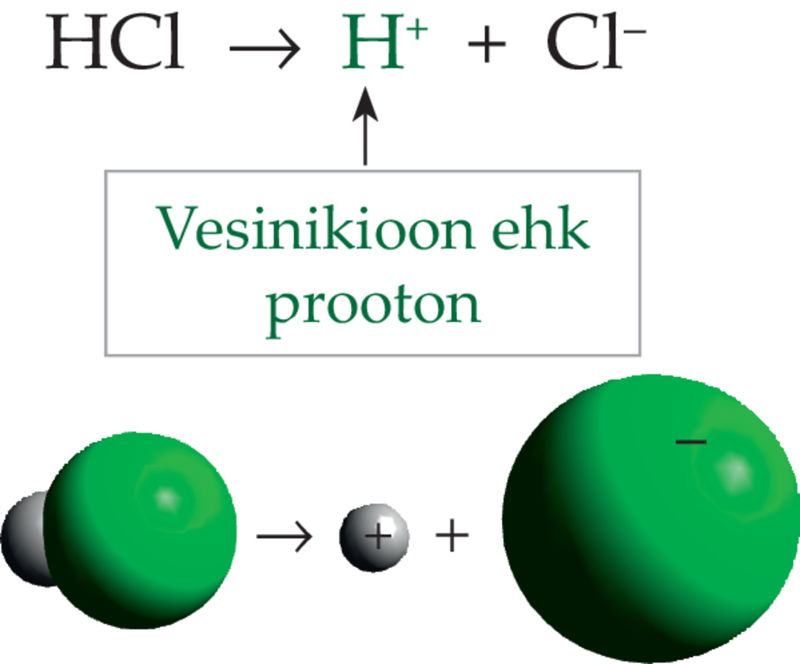
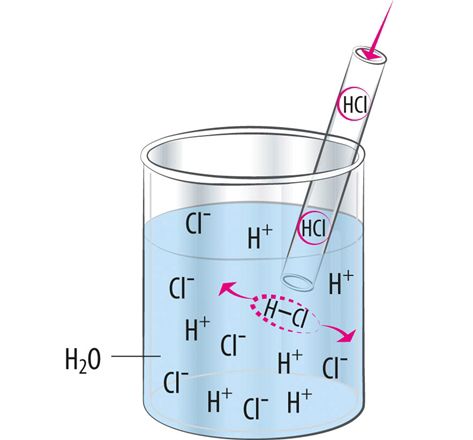
Happed on ained, mis annavad vesilahusesse vesinikioone.
Kõik ained, mille molekulid sisaldavad vesinikuaatomeid, pole veel happed. Näiteks metaanimolekul (CH4) sisaldab nelja vesinikuaatomit, kuid pole hape. Gaasiline vesinik H2 pole samuti hape. Need ained ei anna vesilahusesse vesinikioone.
Happeanioon koosneb ühest või mitmest keemilisest elemendist. Happeaniooni laengu suurus vastab vesinikioonide arvule happemolekulis. Igal happeanioonil on oma nimetus, tuntumad neist on tabelis. Näiteks karboniseeritud karastusjookides sisalduv süsihappe (H2CO3) anioon on laenguga −2 (vastab kahele vesinikioonile) ja seda nimetatakse karbonaatiooniks.
Süsihape – H2CO3, karbonaatioon – CO32– (happeanioon)
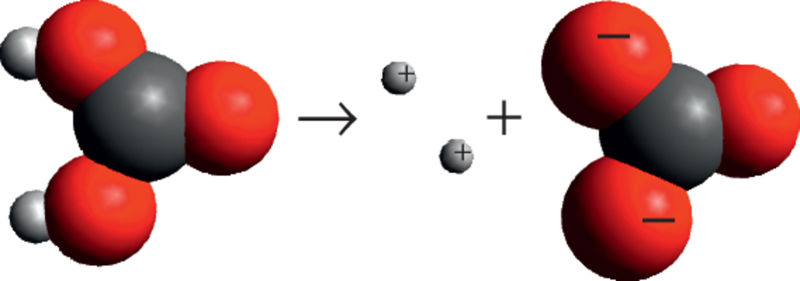
Tuntumate anioonide valemid ja nimetused
Valem | Nimetus |
Cl– | Kloriid |
NO3– | Nitraat |
SO42– | Sulfaat |
SO32– | Sulfit |
S2– | Sulfiid |
CO32– | Karbonaat |
SiO32– | Silikaat |
PO43– | Fosfaat |
Happe tugevus
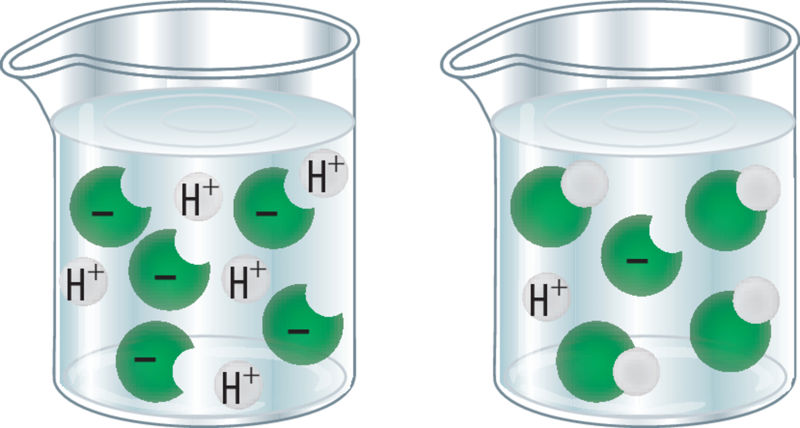
Happe kasutusvaldkond sõltub otseselt happe omadustest. Peale eelkäsitletud omaduste on oluline veel happe tugevus. Hape on seda tugevam, mida suurem osa happemolekulidest on jaotunud ioonideks. Näiteks soolhape (HCl) on väga tugev hape, st kõik happemolekulid on jaotunud ioonideks. Tugevad happed on ka lämmastikhape (HNO3) ja väävelhape (H2SO4). Süsihape (H2CO3) on nõrk hape ja esineb lahuses peamiselt molekulidena, ioone on lahuses vähe.
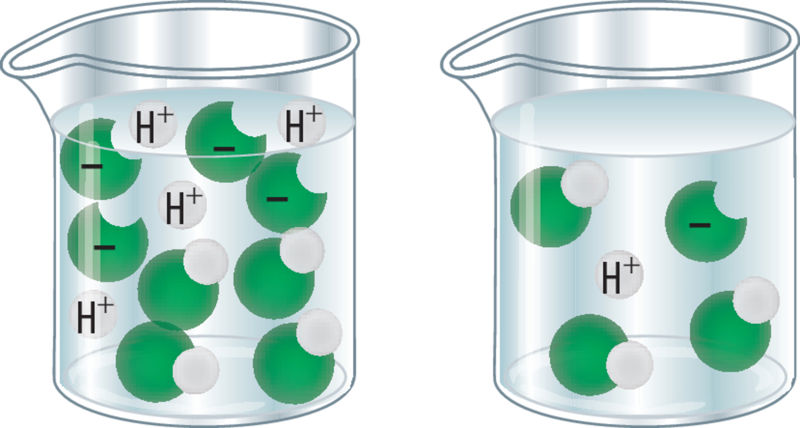
Siinkohal tuleb vahet teha happe tugevusel ja kontsentrasioonil. Happe kontsentratsioon näitab happesisaldust lahuses. Kontsentreeritud happelahuse korral on hapet lahuses rohkem kui lahja lahuse korral. Näiteks sisaldab kontsentreeritud lämmastikhappelahus hapet umbes 70%, lahjemas happelahuses võib lämmastikhapet olla vaid 30%.
Mida rohkem happemolekule on lahuses jaotunud ioonideks, sedasee hape on.
Mida rohkem hapet happelahus sisaldab, seda see lahus on.
Hapete ohutu kasutamine
Hapetega töötades on esmatähtis järgida ohutusnõudeid, sest happed reageerivad kergesti teiste ainetega ja võivad olla söövitava toimega. Iseäranis tähelepanelik ja hoolas peab olema kontsentreeritud ehk kõrge kontsentratsiooniga happelahuste kasutamisel. Kui vaja, tuleb katsed teha tõmbekapis ja kasutada kaitsevahendeid: kaitseprille, kummikindaid ja laborikitlit.
Hapet (eriti väävelhapet) lahjendades tuleb valada hapet peene joana vette. Kui valada vett happesse, võib happe jagunemisel ioonideks eralduda nii palju soojust, et vesi aurustub ja happelahus pritsib anumast välja.
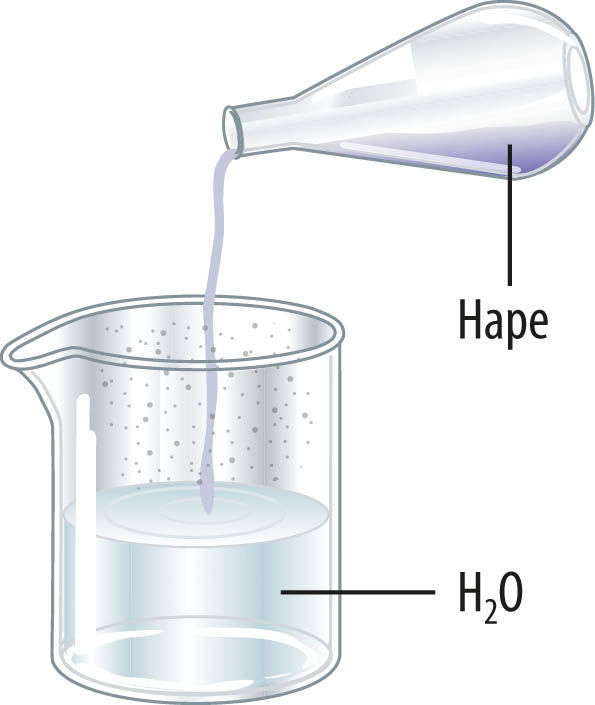
Hapet lahjendades tuleb hapet lisada vähehaaval peene joana vette, mitte vastupidi!
Kui kontsentreeritud hapet satub nahale, tuleb see esmalt voolava veega maha pesta. Kui vaja, tuleb kahjustatud kohta lahja söögisooda või nuuskpiirituse lahusega loputada ning seejärel uuesti veega loputada. Õnnetusest tuleb teavitada õpetajat.
 | ||
1. Pese hape voolava veega maha. | 2. Kui vaja, loputa kahjustatud kohta lahja söögisooda või nuuskpiirituse lahusega. | 3. Loputa kahjustatud kohta uuesti veega. |
- Hapete tugevust saab hinnata neid maitstes.
- Hapetega töötades tuleb hoolega järgida ohutusnõudeid.
- Vajaduse korral tuleb hapetega töötada tõmbekapis.
- Hapete lahjendamisel tuleb happele lisada vett ettevaatlikult peene joana.
- Nahale sattudes tuleb hape kohe voolava veega maha pesta.
- Õnnetusest tuleb teavitada õpetajat.
Tuntumad happed
Vesinikkloriidhape ehk soolhape (HCl)
Soolhape on värvuseta vedelik, millele annab terava lõhna sellest eralduv gaasiline vesinikkloriid. Eralduv gaas võib sissehingamisel söövitada hingamisteede kudesid. Soolhape on väga tugev hape, kuna see on lahuses täielikult ioonideks jagunenud.
Tööstuses toodetakse soolhapet suures koguses ja kasutatakse mitmesuguste metallide kloriidide saamiseks, metallide söövitamiseks, pindade puhastamiseks, värvainete (nt fuktsiinpunase) ja plastide (nt PVC) tootmiseks.
Maomahla koostisainena osaleb soolhape toiduainete seedimises. Mao ülihappesus põhjustab mao limaskestas haavandeid, alahappesus raskendab aga seedimisprotsessi.
Lämmastikhape (HNO3)
Lämmastikhape on üks peamisi happeid keemiatööstuses, HNO3 on väga tugev ja söövitav hape, mis reageerib paljude metallidega. Sellised materjalid nagu puit, paber ja riie võivad lämmastikhappega kokku puutudes koguni süttida.
Suurem osa HNO3 kogutoodangust kasutatakse väetiste tootmiseks. Lämmastikhappe baasil valmistatakse ka lõhkeaineid (nt nitroglütseriini), värve (nt nitrovärve) ning raketikütuseid.
Kontsentreeritud soolhappe ja lämmastikhappe segu vahekorras 3 : 1 nimetatakse kuningveeks. Kuningvesi on eriline selle poolest, et reageerib väärismetallidega (kulla, plaatina ja teistega).

Väävelhape (H2SO4)
Väävelhape on suure tihedusega õlitaoline vedelik ja üks tugevamaid happeid. H2SO4 lahustumisel vees eraldub suures koguses soojust. Väävelhapet kasutatakse gaaside kuivatamiseks, kuna see seob vett. Väävelhape söestab paljusid ühendeid, näiteks suhkrut. H2SO4 tarvitatakse veel väetiste, värvide (nt indigokarmiini), lõhkeainete, plastide ja ravimite tootmisel. Kontsentreeritud H2SO4 võib olla ka autoakude täitevedeliku koostises.
Väävlishape (H2SO3)
Väävlishape tekib gaasilise vääveldioksiidi (SO2) reageerimisel veega. Selline protsess toimub näiteks looduses siis, kui väävlit sisaldavate kütuste (nt põlevkivi) põlemisel tehastest eralduv SO2 reageerib vihmaveega. Selle tulemusel tekkinud happesademed kahjustavad elukeskkonda, ehitisi, transpordivahendeid jm.
Väävlishape on suhteliselt ebapüsiv, see laguneb üsna kergesti tagasi veeks ja vääveldioksiidiks. Väävlishapet kasutatakse pleegitamiseks ja desinfitseerimiseks.

Süsihape (H2CO3)
Süsinikdioksiid (CO2) lahustub vees sellega osaliselt reageerides ja moodustab väga nõrga happe – süsihappe.
Selline protsess toimub näiteks karastusjookide valmistamisel. H2CO3 on ebapüsiv ning laguneb kergesti taas süsihappegaasiks ja veeks, seetõttu eraldubki kihiseva joogi pudelit avades gaas (CO2).
Fosforhape (H3PO4)
Puhas fosforhape on toatemperatuuril värvitu tahke ja keskmise tugevusega hape. Laboris kasutatav H3PO4 vesilahus on õlitaoline vedelik. Fosforhapet toodetakse suures koguses ja kasutatakse laialdaselt, enamasti tehakse sellest fosforväetisi. Fosforhapet leidub pesuvahendites ja see on ka üks toidu lisaaineid. Näiteks lisatakse fosforhapet karastusjookidesse, et neile maitset anda ja pidurdada neis mikroorganismide kasvu.
Süsi- ja fosforhappeanioone leidub ka meie veres, kus need hoiavad ja säilitavad õiget happe-aluse tasakaalu.

Ma tean, et
- Hape on aine, mis annab vesilahusesse vesinikioone (H+).
- Happed on hapu maitsega söövitavad ained.
- Happemolekulid jagunevad vesilahustes positiivselt laetud vesinikioonideks ehk prootoniteks ja negatiivselt laetud anioonideks.
Küsimused ja ülesanded
- Mille poolest hapete koostised sarnanevad ja mille poolest erinevad?
- Millest on tingitud hapete omadused?
- Kirjelda ohutut töötamist hapetega.
- Nimeta need happed: HNO3, H2SO3, H2CO3, H2S.