Vere happelisus ja aluselisus
Inimese veri on nõrgalt aluseline. Paanikahoo ajal kaotab keha rohkem veres lahustunud süsihappegaasi kui tavaliselt. Seetõttu süsihappegaasi (ja süsihappe) sisaldus veres väheneb ja veri muutub aluselisemaks. Sellisel juhul aitab, kui hingata sisse-välja paberkotti. Nii omastatakse väljahingatud süsihappegaas, veri muutub taas veidi happelisemaks ja saavutab tasakaalu.

Aluse tunnuseid
Aluselisi toiduaineid on happelistest oluliselt vähem ning nende maitse pole nii selgesti eristatav. Aluseline lahus tundub näppude vahel katsudes libe, sest alus reageerib sõrmedel oleva rasvaga ja moodustab seebi. Alused on kehale võõramad kui happed, seetõttu võib suures koguses aluselise aine allaneelamine olla isegi ohtlikum kui happelise aine neelamine. Alused võivad samuti olla söövitava toimega ning tekitada pikemaajalisel kokkupuutel nahale söövitushaavu.

- Alused on magusa maitsega.
- Aluseid ei tohi laboris maitsta.
- Alused on näppude vahel katsudes libedad.
- Alused võivad olla söövitavad.
- Alused on ohutud ained.
- Alused reageerivad rasvadega.
Aluste koostis
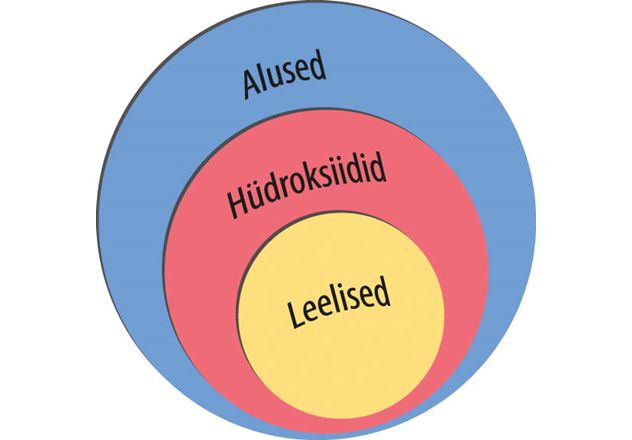
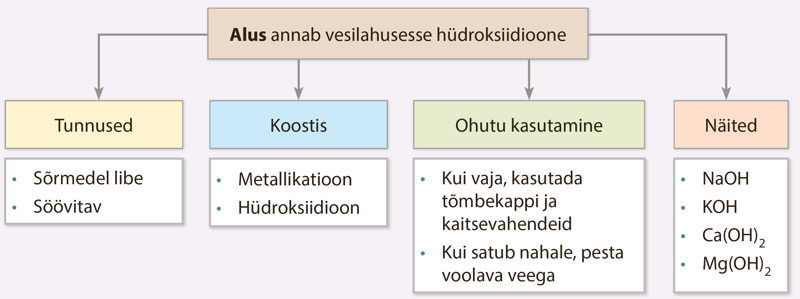
Aluseid on väga mitmesuguseid, kõige tuntumad neist on hüdroksiidid. Hüdroksiid on metallikatioonidest ja hüdroksiidioonidest (OH–) koosnev aine. Aluste omadused on tingitud just aluste lahuses esinevatest hüdroksiidioonidest.
Üks tuntumaid hüdroksiide, torupuhastusvahendi koostisesse kuuluv naatriumhüdroksiid (NaOH) esineb vesilahuses naatrium- ja hüdroksiidioonidena.
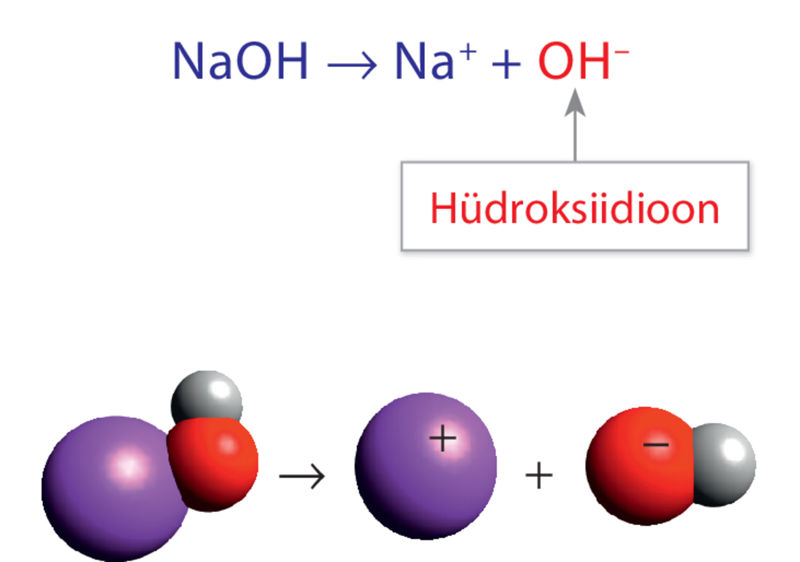
Alused on ained, mis annavad vesilahusesse hüdroksiidioone.
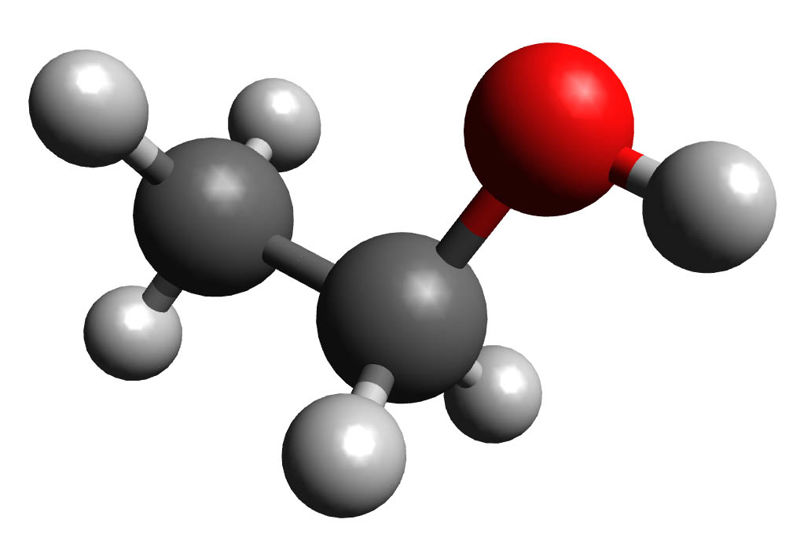
Samas ei tohi unustada, et kõik OH-rühma sisaldavad ained pole veel alused. Alkoholides, näiteks etanoolis (CH3–CH2–OH), on OH-rühm seotud kovalentselt süsiniku külge (vt ptk 3.2) ja vees lahustunult ei saa OH-rühm alkoholist eralduda, mistõttu pole tegemist alusega.
- CH3OH
- NaOH
- Li2O
- Mg(OH)2
- HClO4
- KOH
- P4O10
- Fe(OH)3
- H2S
- HNO2
- NaCl
- Cu(OH)2
Hüdroksiidide valemid ja nimetused
Hüdroksiidid on ioonilised ained, mistõttu on nende valemid lihtsustatud ja näitavad katioonide ja anioonide suhet ainetes. Hüdroksiidi valemit koostades tuleb meeles pidada, et aine tervikuna on laenguta ehk neutraalne.
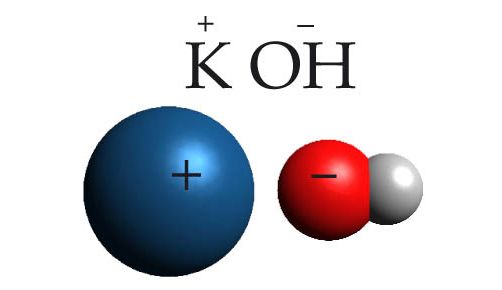
Näiteks on kaaliumioon laenguga +1 ja hüdroksiidioon laenguga −1, laengud annavad kokku nulli ja kaaliumhüdroksiidi valem on seega KOH.
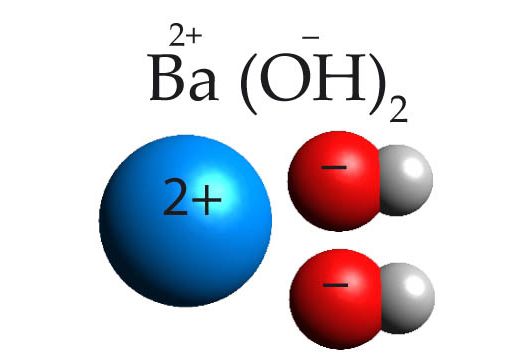
Baariumiooni laeng on +2, laengute võrdsustamiseks peab baariumiooniga olema seotud kaks hüdroksiidiooni ja baariumhüdroksiidi valem on Ba(OH)2. Kui hüdroksiid sisaldab kaks või enam hüdroksiidiooni, tuleb hüdroksiidioon panna sulgudesse, et indeks kehtiks kogu hüdroksiidiooni (OH−), mitte ainult vesiniku kohta.
Hüdroksiididele nimetuse andmine on lihtne: vastava metalli nimetusele lisatakse sõna hüdroksiid.
- NaOH – naatriumhüdroksiid
- KOH – kaaliumhüdroksiid
Juhul, kui metall võib moodustada hüdroksiide erinevates oksüdatsiooniastmetes, täpsustatakse nimetuses metalli oksüdatsiooniaste.
Hüdroksiidioonide arv valemis on võrdne metalli oksüdatsiooniastme (metalliooni laengu) suurusega.
Mg(OH)2 –
Cu(OH)2 –
Al(OH)3 –
Fe(OH)3 –
Aluste tugevus
Nii nagu happed, on ka alused erineva tugevusega. Alus on seda tugevam, mida suurem osa alusest on vesilahuses jaotunud ioonideks.
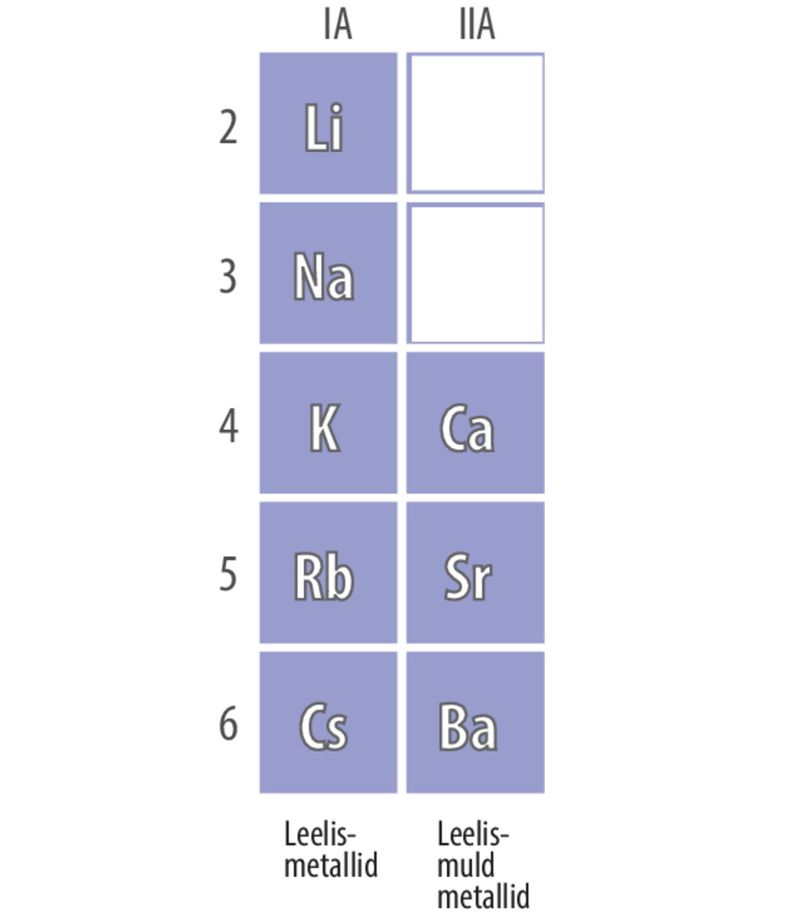
Tugevate aluseliste omadustega hüdroksiide, mis vee toimel täielikult ioonideks jagunevad, nimetatakse leelisteks. Leelised koosnevad hüdroksiidioonidest ja kergesti reageerivate metallide katioonidest: IA rühma metallidest ehk leelismetallidest ning IIA rühma metallidest Ca, Sr ja Ba ehk leelismuldmetallidest. Enamik ülejäänud metallide hüdroksiide ei jagune vees peaaegu üldse ioonideks, mistõttu annavad nad vesilahustesse hüdroksiidioone väga vähe ja nende aluselised omadused on nõrgad.
- Al(OH)3
- NaOH
- Ca(OH)2
- Fe(OH)3
- Mg(OH)2
- Ba(OH)2
- RbOH
- Cu(OH)2
- LiOH
Aluste ohutu kasutamine
Kuna tugevad alused on söövitava toimega ja tekitavad nahale sattunult söövitushaavu, tuleb nendega töötades järgida ohutusnõudeid. Kui vaja, peab alustega töötama tõmbekapis ja kasutama kaitsevahendeid: kaitseprille, kummikindaid ja laborikitlit.

Kui alust satub nahale või riietele, tuleb see veega maha pesta. Kui vaja, tuleb kahjustatud kohta lahja äädikaga loputada ning seejärel uuesti veega loputada. Koolis olles tuleb õnnetusest teavitada õpetajat, mujal tuleb õnnetuse korral kiiresti rääkida mõne vanema inimesega.
 | ||
1. Pese alus voolava veega maha. | 2. Kui vaja, loputa kahjustatud kohta lahja äädikaga. | 3. Seejärel loputa kahjustatud kohta uuesti veega. |
Tuntumad alused
Naatriumhüdroksiid (NaOH)
Naatriumhüdroksiid on üks tuntumaid aluseid. See on valge tahke ja väga söövitav aine. Naatriumhüdroksiid lahustub vees väga hästi ja seejuures eraldub palju soojust.
Naatriumhüdroksiidi kasutatakse puhastusvahendite (seebid, pesuvahendid, torupuhastusvahendid), paberi ja lõhkeainete valmistamiseks ning vedelkütuste töötlemiseks. NaOH tuntakse ka seebikivi nime all, sest kui keeta rasva koos sellega, saadakse seep.

Kaaliumhüdroksiid (KOH)
Kaaliumhüdroksiid on valge kristalne aine, mis lahustub vees väga hästi ja on tugev alus. Kaaliumhüdroksiidi tuleb ettevaatlikult kasutada: kui see nahale satub, tekivad raskesti paranevad haavad. Kaaliumhüdroksiidilahus söövitab isegi klaasi.
Kaaliumhüdroksiidi kasutatakse vedelseepide ja mitmesuguste kaaliumiühendite (nt kaaliumväetiste) tootmisel. Seda tugevat alust sisaldavad ka patareid ja seda rakendatakse naha töötlemisel (karvade eemaldamisel).

Kaltsiumhüdroksiid (Ca(OH)2)
Kaltsiumhüdroksiidi saadakse kaltsiumoksiidi (CaO) reageerimisel veega, st kustutamata lubja „kustutamisel”. Seetõttu nimetatakse Ca(OH)2 ka kustutatud lubjaks.
Kaltsiumhüdroksiid on valge tahke aine, mis vees lahustub üpris vähe. Veega moodustab Ca(OH)2 valge hägusa segu, mida nimetatakse lubjapiimaks. Seda filtreerides saadakse läbipaistev värvuseta kaltsiumhüdroksiidi lahus – lubjavesi –, mis on tugevate aluseliste omadustega.
Kustutatud lubjaga saab näiteks põllumajanduses vähendada mulla happesust, tööstuses kasutatakse seda lubimördi ja muu ehitusmaterjali valmistamiseks. Samuti on kustutatud lubi oluline nahatööstuses ja hambaravis.

Alumiiniumhüdroksiid (Al(OH)3)
Alumiiniumhüdroksiid on vees peaaegu lahustumatu alus. See moodustab vees valge geelja sademe, mida kasutatakse näiteks veepuhastusjaamades veest mittevajalike lisandite eemaldamiseks (vt ptk 5.1).

Magneesiumhüdroksiid (Mg(OH)2)
Magneesiumhüdroksiid on valge tahke ja vees peaaegu lahustumatu nõrgalt aluseline aine. Kui see vette satub, tekib valge suspensioon (vt ptk 5.5) – magneesiapiim. Seda kasutatakse mao ülihappesuse vähendamiseks.

Ammoniaakhüdraat (NH3∙H2O)
Ammoniaakhüdraat moodustub, kui ammoniaagimolekulid (NH3) seostuvad veemolekulidega. NH3∙H2O on värvuseta teravalõhnaline ja nõrgalt aluseline vedelik.

- Nõrk alus, mida kasutatakse nuuskpiirituses.
- Vees lahustumatu nõrk alus, mida kasutatakse veepuhastusjaamades väga väikeste mittevajalike osakeste eemaldamiseks.
- Väga tugev alus, mis söövitab klaasi ja mida kasutatakse patareides.
- Väga tugev alus, mida kasutatakse puhastusvahendite koostises.
Ma tean, et
- Alus on aine, mis annab vesilahusesse hüdroksiidioone (OH–).
- Hüdroksiid on alus, mis koosneb metallikatioonidest ja hüdroksiidioonidest.
- Leelis on tugevate aluseliste omadustega hüdroksiid, mis koosneb leelis- või leelismuldmetalli katioonidest ja hüdroksiidioonidest.
Küsimused ja ülesanded
- Millest on tingitud aluste omadused?
- Kirjuta hüdroksiidide valemid: liitiumhüdroksiid, magneesiumhüdroksiid, vask(II)hüdroksiid, kroom(III)hüdroksiid.
- Nimeta need hüdroksiidid: KOH, Ca(OH)2, Fe(OH)2, Al(OH)3.