Tunni ülesehitus
- Sissejuhatus, 7 min
- Ained, aatomid ja molekulid, 5 min
- Vee molekul, 8 min
- Vesi kui lahusti, 8 min
- Kartulikatse lõpetamine, 10 min
- Kokkuvõte, 7 min
Ettevalmistus
- Õpetajal on valmis pandud kartulikatse lõpetamiseks vajalikud vahendid (kuivanud kartulipudi ja toidukaal).
- Õpilastel on kaasas pakk väikeseid värvilisi komme (sobivad näiteks Skittles või M&M’s) ja väike ühevärviline (eelistatult valge) taldrik (või jogurtitopsi kaas, kaalusalati karp vm väike ühevärviline anum).
Eelteadmised
Õpilane teab, et
- vett vajab kogu elusloodus;
- magneti vastaspoolused tõmbuvad ja samasugused poolused tõukuvad.
Eesmärgid
- Õpilane teab, et
- ained koosnevad aatomitest ning aatomid võivad moodustada molekule;
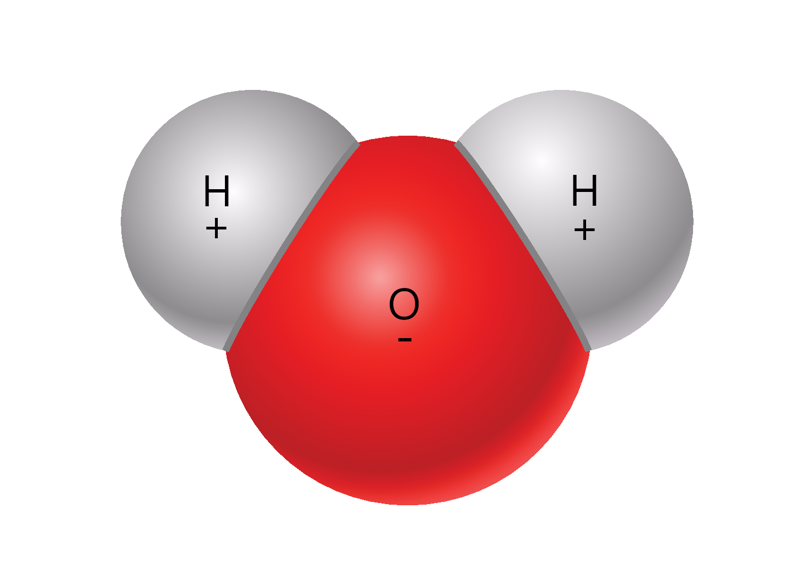
- vee molekul koosneb kahest vesiniku ja ühest hapniku aatomist;
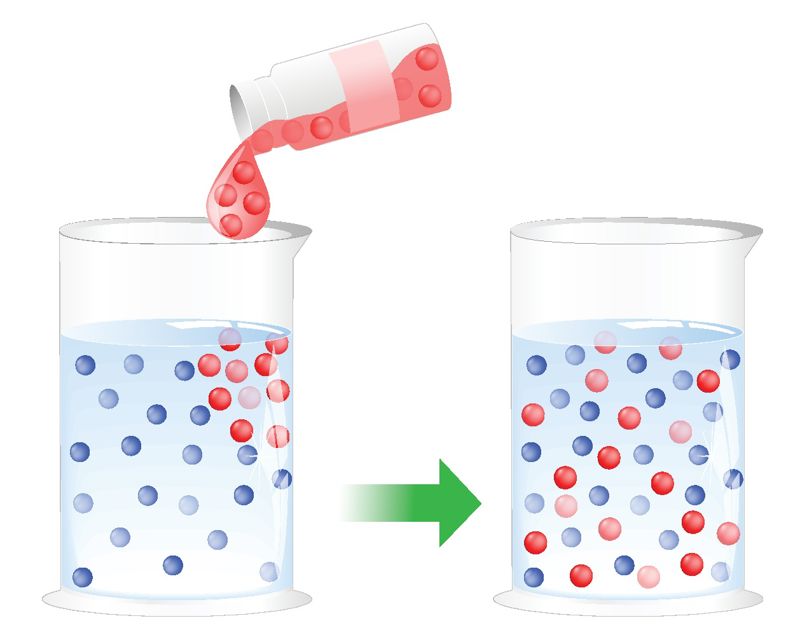
- vesi on väga hea lahusti.
Seotud materjal
- ptk 1.2 „Vesi kui aine. Vee omadused“
- lk 10–13
- I osa lk 6–7
Märksõnad ja meetodid
- aine, molekul, aatom, lahus, lahusti
- katse, liikumisülesanne, rühmatöö, animatsioon
Lõiming
3. kl loodusõpetus
- Elekter ja elektrivool (lk 30–31)
- Magnet ja kompass (lk 36–37)
7. kl loodusõpetus
- Mis on aatom? (lk 50–51)
- Keemilised sidemed (lk 80–81)
- Liht- ja liitained (lk 82–83)
- Ainete segud (lk 106–107)
- Mis on lahus? (lk 108–109)